Иммунодефициты
Иммунная система обеспечивает постоянство внутренней среды, защиту от инфекций и сохраняет здоровье человека. Врожденный иммунитет обеспечивают моноциты, нейтрофилы, естественные киллеры, а приобретенный — T- и B-клетки. При нормальном иммунном ответе инфекционное заболевание может не развиться либо закончиться быстрым выздоровлением.
Воздействие на иммунную систему неблагоприятных факторов приводит к нарушению ее функции — формируется иммунодефицит человека (синонимы иммунодефицитное состояние, иммунная недостаточность). Это состояние, при котором организм не способен противостоять инфекциям и связано с тем, что снижается количество и активность клеток иммунной системы. На фоне сниженного иммунитета острые инфекции переходя в хроническую форму, развиваются оппортунистические инфекции (герпес, кандидоз слизистых) и аутоиммунные заболевания, постоянно обостряются хронические инфекции (синусит, бронхит, отит, тонзиллит), появляются различного рода аллергические состояния.
Выделяют два вида нарушений иммунной системы — первичный иммунодефицит (врожденный) и вторичный (приобретенный), основным проявлением которых является повышение инфекционной заболеваемости. Тяжелый первичный иммунодефицит встречается у 1 из 10 000 человек, а легкая форма (например, недостаточность только иммуноглобулинов класса А) встречается у 1 из 300 человек. Вторичный встречается чаще, но реже диагностируется, поскольку постоянные изменения в иммунограмме отсутствуют или их вообще нет. При любом варианте иммунной недостаточности важна ранняя диагностика, что предупреждает в дальнейшем развитие тяжелых поражений органов и снижение качества жизни пациента.
Патогенез
Иммунная система начинает формироваться на 4–5 неделе эмбрионального развития, а к рождению организм уже в состоянии ответить на воздействие различных инфекционных агентов. В силу многих причин возникают генетические мутации и развиваются врожденные дефекты клеточного и гуморального звена иммунитета, что приводит к стойкой его дисфункции. Дефекты заключаются в количественном дефиците Т и В-клеток, нарушении их дифференцировки, нарушении синтеза иммуноглобулинов, и они присутствует с рождения.
В патогенезе развития приобретенной иммунной недостаточности отмечают основные моменты:
- нарушение функции иммуноцитов;
- гибель клеток иммунной системы под действием ионизирующей радиации, цитостатиков, иммунодепрессантов;
- уменьшение клеток, синтезирующих иммуноглобулины;
- преобладание активности супрессорных факторов.
Все эти факторы приводят к неадекватному иммунному ответу и развитию синдрома системной воспалительной реакции (SIRS), для которой характерны изменение температуры (повышение или понижение), тахикардия, одышка, изменение количества лейкоцитов.
При вирусных инфекциях имеет значение тропность вируса к лимфоцитам и макрофагам, которые имеют отношение к иммунитету, и подавление их активности, снижение синтеза цитокинов, антител и способности макрофагов поглощать чужеродные антигены. При вирусных инфекциях снижается количество и активность T-лимфоцитов, а также переваривающей способности нейтрофилов. При тяжелых инфекциях снижается уровень иммуноглобулинов (изменяется гуморальное звено иммунитета).
При рецидивирующих бактериальных инфекциях бактерии снижают способность фагоцитов их поглощать, при длительных инфекциях снижают бактерицидную способность крови, уровень пропердина и активность системы комплемента. Снижение бактерицидности сопровождается вторичным инфицированием кожи грибами, стафилококком и кишечной палочкой. Некоторые бактерии способны размножаться внутри фагоцитирующих клеток, что является причиной затяжной и хронической бактериальной инфекции и бактерионосительства.
Классификация
- Первичный иммунодефицит — это врожденные состояния, связанные с мутациями генов, которые контролируют иммунный ответ. Дефекты генов могут затрагивать несколько звеньев иммунитета: клеточный, гуморальный, фагоцитоз и систему комплемента. Описано 300 таких генетических мутаций, для которых характерны стойкие нарушения иммунных параметров, проявляющиеся в раннем детстве жизнеугрожающими инфекциями, опухолевыми заболеваниями и аутоиммунной патологией. Самой распространенной формой первичного иммунодефицита является иммунодефицит с преимущественной недостаточностью синтеза антител, при котором антитела при инфекционных заболеваниях не вырабатываются или вырабатываются в уменьшенном количестве. Пациентам с нарушением антителообразования проводится заместительная терапия иммуноглобулинами, что предотвращает тяжелые и жизнеугрожающие инфекции. Т-клеточные и комбинированные дефициты манифестируют до 6 месяцев и протекают тяжелее, чем связанные с дефектом антител.
- Вторичный иммунодефицит — это приобретенное состояние, не связанное с генетическими дефектами и возникающее в процессе жизни. Встречается чаще, чем первичный и развивается при хронических заболеваниях, которые приводят к снижению иммуноглобулинов: миелодиспластический синдром, опухоли лимфоидной ткани, муковисцидоз, саркоидоз, целиакия, солидные опухоли. В связи с этим не являются самостоятельной нозологией. Вторичные иммунодефициты — преходящие состояния и исчезают при исключении неблагоприятного фактора.
В зависимости от генетического дефекта первичные иммунодефициты делят на большие группы:
- дефекты гуморального звена (составляют большую часть);
- клеточного звена;
- фагоцитов;
- комплемента;
По обратимости нарушений вторичные состояния бывают:
- обратимые;
- необратимые.
Формы вторичной недостаточности:
- Приобретенная — типичной приобретенной формой является СПИД — вирусный иммунодефицит, связанный с поражением вирусом лимфоидной ткани.
- Индуцированная — причинами являются рецидивирующие бактериальные, вирусные и грибковые инфекции, аутоиммунная и аллергопатология, новообразования, болезни крови; нарушения питания, патология ЖКТ, рентгеновское излучение, химио-цитостатическая терапия.
- Спонтанная — причину нарушений не удается установить.
Варианты течения вторичной иммунной недостаточности:
- Присутствуют клинические и лабораторные маркеры. При этом течении обоснованным является назначение иммуномодуляторов.
- Присутствуют только клинические проявления, а иммунограмма нормальная. Показана иммуномодулирующая терапия.
- Изменения в иммунном статусе затрагивают только одно звено иммунитета, а клинические проявления отсутствуют. С назначением иммуномодуляторов не спешат, поскольку через несколько месяцев изменения исчезают.
Причины иммунодефицитов
- Причины первичной иммунной недостаточности — генетические мутации. В большинстве случаев — это дефекты в генах, которые отвечают за дифференцировку иммунных клеток. Отмечается аутосомно-рецессивное наследование.
- Тератогенные воздействия — чаще всего врожденный иммунодефицит и пороки развития вызывают TORCH-инфекции.
Развитие вторичных иммунных нарушений связано со многими факторами:
- Возраст пациента. Возрастные иммунодефициты встречаются в раннем возрасте и старческом. Так у недоношенных новорожденных отмечается незрелость и незавершенность гуморального и клеточного иммунитета и снижение способности к выработке антител. У пожилых отмечается инволюция тимуса возраста часто рецидивирующие инфекционно-воспалительные заболевания (ИВЗ) могут быть обусловлены и связанного с этим снижением секреции его гормонов, развитием необратимых изменений в системе гуморального и клеточного иммунитета.
- Неблагоприятная экологическая обстановка (радиационное и химическое воздействие).
- Вредные факторы производства и условия труда (стрессы у летчиков, сверхвысокие нагрузки у спортсменов, воздействие высоких или низких температур).
- Побочные эффекты некоторых препаратов. Лекарственный иммунодефицит, проявляющийся преходящим снижением IgG и IgA, вызывают Каптоприл, Диклофенак, Сульфасалазин, Карбамазепин, Делагил, Плаквенил), Дифенин, Купренил.
- Вирусные инфекции. Вирусы (гриппа, гепатита, кори, цитомегаловирус) имеют тропность к иммунокомпетентным клеткам (лимфоциты, макрофаги) и подавляют их активность, способность синтезировать цитокины и антитела. Вирус иммунодефицита человека поражает макрофаги и CD4-положительные T-клетки, вызывая медленно прогрессирующую инфекцию, поздней стадией которой является синдром приобретенного иммунодефицита. Переход к СПИДУ сопровождается тяжелым иммунодефицитом и у человека развиваются оппортунистические инфекции — кандидоз, цитомегаловирусная болезнь, пневмоцистная пневмония, криптококкоз, кокцидиоидомикоз, простой герпес, токсоплазмоз головного мозга.
- Бактериальные инфекции. Бактерии вызывают нарушения в гуморальном и фагоцитарном звеньях — отмечаются гипогаммаглобулинемия и снижение фагоцитоза. В норме иммунный ответ на бактериальное воспаление включает повышение иммуноглобулинов классов А, М и G, показателей поглотительной способности фагоцитов.
- Удаление селезенки. В течение первых лет после удаления селезенки чаще развиваются инфекции, вызванные Streptococcus pneumoniae, Neisseria meningitides и Haemophilus influenzae. Также характерны эпизоды пневмококковой бактериемии, которая имеет молниеносное течение и приводит к смерти в течение нескольких часов.
- Нерациональное питание и белково-калорийная недостаточность (квашиоркор, алиментарная дистрофия). Это серьезное заболевание, приводящее к иммунокомпрометации, снижает способность противостоять инфекциям. На этом фоне инфекционная диарея, пневмония, туберкулез, сальмонеллез и инфекция, вызываемая грибами-аскомицетами, часто вызывают смерть истощенных грудных детей.
- Иммуносупрессивная терапия, которая проводится при пересадке костного мозга и органов
- Онкологические и онкогематологические заболевания.
- Малоподвижный образ жизни.
- Хронические вялотекущие инфекционно-воспалительные процессы.
У детей ослабляет функции иммунитета внутриутробная гипотрофия и гипоксия, недоношенность, родовая травма с повреждением мозга, инфицирование плода (сифилисом, хламидиозом, гриппом, цитомегаловирусом, герпесом, мононуклеозом, гепатитом, токсоплазмозом), церебральный паралич, резус-конфликт, гемолитическая болезнь.
Симптомы иммунодефицитов
Симптомы иммунодефицита как первичного, так и вторичного одинаковы — частые и длительные инфекции. Инфекционные заболевания отличаются тяжестью, продолжительностью и осложнениями. Однако первыми симптомами могут быть и неинфекционные проявления — аутоиммунные процессы, изменения крови и неврологические нарушения. Аутоиммунные проявления или ограничены поражением отдельных тканей (гемолитическая анемия, тромбоцитопения, тиреоидит) или бывают системными (васкулиты, ревматоидный артрит, красная волчанка).
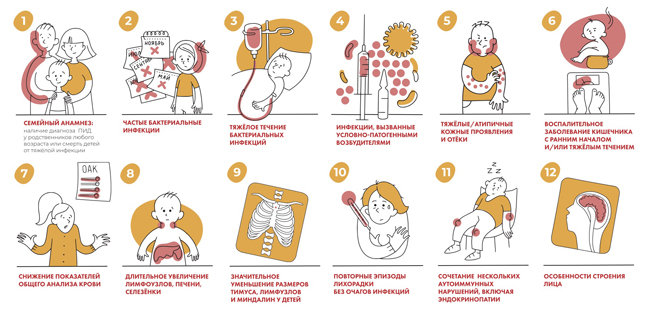
Настораживающие признаки первичного иммунодефицита
Пациенты склонны к бактериальным, грибковым, вирусным и паразитарным инфекциям. У них постоянно рецидивируют отиты, синуситы, пневмонии, тяжелые абсцессы, менингит, сепсис, отмечаются инфекционные артриты, грибковые поражения не только кожи, но и внутренних органов с хронической диареей и потерей веса.
Патологическая лимфопролиферация проявляется стойким увеличением лимфоузлов нескольких групп, увеличением селезенки, лимфоцитарная инфильтрация слизистой ЖКТ и легких. Характерно развитие бронхоэктазов у молодых и злокачественных образований лимфоидной ткани. Также часто отмечаются оппортунистические инфекции, вызываемые возбудителями, которые не опасны для лиц с нормальным иммунитетом, но смертельно опасны для иммунокомпрометированных пациентов. К оппортунистическим инфекциями относится герпесвирусные, кандидоз, пневмоцистная пневмония (вызывается грибом Pneumocystis jirovecii) со смертельным исходом, аспергиллез легких. Плесневой грибок Aspergillus Fumigatus у иммунокомпрометированного пациента вызывает не только аспергиллез, но и опухолевидное образование аспергиллому. Полиомавирусы вызывают инфекции почек и центральной нервной системы. При оппортунистических инфекциях отмечается генерализованное поражение.

Признаки первичного иммунодефицита у детей
При ранних проявлениях иммунодефицита и отсутствии лечения дети отстают в росте. Взрослые с диарейным синдром тоже имеют дефицит веса. При хронических процессах появляются характерные симптомы «часовых стекол» и «барабанных палочек», деформации суставов в следствие перенесенных несколько раз инфекционных артритов.
Анализы и диагностика
На основании опроса больного и изучения его медицинской карты легко устанавливается повышенная инфекционная заболеваемость, хронические рецидивирующие воспалительные процессы и безэффективность к проводимому стандартному лечению. При осмотре выявляется субфебрилитет, пониженный вес и увеличенные лимфоузлы.
Стандартный тест на иммунодефицит включает:
- Клинический анализ крови. Обязателен подсчет количества лейкоцитов, лимфоцитов и нейтрофилов и определение СОЭ. Отмечается снижение количества лимфоцитов — лимфопения выявляется у больных с Т-клеточным первичным иммунодефицитом и тяжелом комбинированном. Уменьшение количество нейтрофилов указывает на циклическую нейтропению или врожденный агранулоцитоз.
- Определение иммуноглобулинов IgG, IgA и IgM — отмечается снижение их уровня. Снижение IgА отмечается при первичном иммунодефиците и рецидивирующих гнойных заболеваниях.
- Определение общей гемолитической активности системы комплемента CH50 — это скрининговый тест.
- Цитокины лимфоцитов хелперов Th1 и Th2. Снижение продукции основного цитокина Th1 интерферона-гамма отмечается при врожденных иммунодефицитах, грибковых и бактериальных инфекциях, ВИЧ-инфекции.
Для детального изучения статуса назначаются исследование:
- Фагоцитарной функции. Отмечается уменьшение активности фагоцитов (нейтрофилов и моноцитов).
- Системы комплемента. Это комплекс защитных белков, которые постоянно присутствуют в крови и являются гуморальной защитой. Если при скрининге выявлено уменьшение общего уровня комплемента CH50, то проверяют каждый уровень комплемента по отдельности.
- Определение интерлейкинового и интерферонового статуса.
- Т-системы иммунитета. Исследуются различные популяции лимфоцитов: СD3+, CD4+, CD20, СD8+, СD19+. Иммунодефициты, связанные с дефектом Т-клеток, протекают тяжелее, чем связанные с дефектом антител.
- В-системы иммунитета. Определяется количество B-лимфоцитов: CD19, СD20.
Дополнительные обследования:
- ПЦР-диагностика вирусных инфекций (гепатиты В, С, ВИЧ-вирус, цитомегаловирусная, инфекция Эпшейна-Барра).
- Рентгенография органов грудной клетки, придаточных пазух и других локализаций.
- Компьютерная томография.
- УЗИ лимфоузлов, брюшной полости и забрюшинного пространства.
- Обследование функции внешнего дыхания.
- ЭКГ.
- Биопсия лимфоузлов, селезенки или других органов.
Молекулярно-генетическое исследование для выявления генетического дефекта. Выявленный дефект подтверждает первичный иммунодефицит. Также проводится пренатальное и неонатальное генетическое исследование. Пренатальный скрининг основан на исследовании околоплодных вод, пуповинной крови или ворсин хориона. Этим методом выявляют синдром Вискотта – Олдрича, агаммаглобулинемию, грануломатозную болезнь и тяжелый комбинированный иммунодефицит.
При неонатальном скрининге в Т-лимфоцитах определяют Т-рецепторные эксцизионные кольца (ТРЭК). Исследование проводят два раза с разницей в две недели. Отсутствие или снижение их характерно для многих первичных иммунодефицитов, в том числе и тяжелых. Проведенная вовремя диагностика позволяет в ранние сроки начать лечение — выполнить пересадку костного мозга, эффективность которой наиболее высока при проведении операции в первые три месяца после рождения.
Лечение иммунодефицитов
Специфические методы лечения заключаются в регуляции иммунного ответа в отношении определенного антигена/антигенов. К этим методам относятся вакцинация, клеточная иммунотерапия, введение иммуноглобулинов и сывороток. Неспецифические методы позволяют корректировать нарушенную иммунную функцию иммуномодуляторами.
Основные направления лечения первичного иммунодефицита с нарушением синтеза антител
- заместительная терапия иммуноглобулинами (применяется иммуноглобулин человека);
- профилактика/лечение инфекционных заболеваний;
- трансплантация стволовых клеток (это возможно при некоторых формах ПИД).
Клинические рекомендации по ведению больных с нарушением синтеза антител предусматривают проведение заместительного лечения иммуноглобулинами пожизненно. Иммуноглобулин вводят внутривенно или подкожно и последнему способу отдается предпочтение. При значимых инфекциях применяется режим насыщения иммуноглобулинами, что означает введение их в дозе 0,6–0,8 г/кг веса один раз в три недели, в поддерживающем режиме доза составляет 0,4 г/кг один раз в три недели.
При всех значительных инфекциях необходимо назначение антибиотиков. Антимикробная терапия должна проводиться одновременно с заместительным лечением, что является залогом успеха. При этом сроки антибактериального лечения в 1,5–2 раза больше по продолжительности обычных схем лечения и составляют 3–4 недели. Назначаются цефалоспорины, аминопенициллин, защищенные пенициллины, карбапенемы и ко-тримоксазол + триметоприм. Противогрибковая терапия назначается по показаниям.
Лечение иммунодефицита вторичного генеза
В данном случае необходимо устранение причины — лечение основного заболевания, что влечет постепенное восстановление иммунной системы. Например, успешное лечение рака или ВИЧ-инфекции. Нормализация уровня сахара позволяет лейкоцитам нормально функционировать и предотвращать инфекции. Если причиной иммунодефицита является длительное лечение, то его стараются закончить.
Основным является борьба с инфекциями и при этом важен правильный выбор антибактериальных/противовирусных средств. При лечении оппортунистических инфекций, например пневмоцистной пневмонии, назначается Бисептол, а цитомегаловирусная инфекция лечится ганцикловиром.
Неспецифическая коррекция нарушений иммунитета
С этой целью применяются иммуномодулирующие препараты. Иммуномодуляторы восстанавливают измененный иммунный ответ и назначаются при повышенной заболеваемости инфекциями, рецидивирующих заболеваниях, неэффективности терапии или для ее усиления.
Основные группы этих препаратов:
- Экзогенные бактериального происхождения: Имудон, Рибомунил, Бронхо-мунал, ИРС-19, Бронхо-Ваксом.
- Эндогенные: цитокины, фактор некроза опухоли альфа, интерфероны, пептиды тимического и костномозгового происхождения, интерлейкины. Препараты: Т-активин, Тималин, Бестим, Неоген, Вилон, Тимоптин, Тимоген, Тимодепрессин. Пептиды костномозгового происхождения: Бивален, Миелопид, Серамил.
- Химические синтетические препараты: Полиоксидоний, Глутоксим, Аллоферон, Галавит, Гепон, Имунорикс.
Экзогенные препараты назначаются при нарушениях Т-клеточных реакций, которые проявляются рецидивирующими инфекциями и гнойно-воспалительными заболеваниями. Механизм экзогенных иммуномодуляторов — стимуляция активности фагоцитов, увеличение фагоцитоза и повышение синтеза провоспалительных цитокинов.
При рецидивирующих инфекциях показаны иммуномодуляторы группы цитокинов. К ним относятся интерлейкины (Ронколейкин, Лейкинферон, Суперлимф, Лейкомакс, Беталейкин, Нейпоген), индукторы интерферонов (Циклоферон, Амиксин), интерфероны (Гриппферон, Герпферон, Виферон, Реаферон, Кипферон, Офтальмферон), фактор некроза опухоли и колониестимулирующий фактор.
Профилактика инфекции после трансплантации стволовых клеток:
- Флуконазол — 3–6 мг/кг до приживления трансплантата.
- Ганцикловир — 5 мг/кг внутривенно дважды в сутки, потом один раз в сутки.
- Ацикловир — начинают инъекции за один день до трансплантации, трижды в день и продолжают до приживления трансплантата.
При уровне IgG <4 г/л показан иммуноглобулин человека, который вводят внутривенно до восстановления синтеза своего иммуноглобулина. Показано, что он уменьшает тяжесть острого состояния «трансплантат против хозяина» у реципиентов аллогенных трансплантатов костного мозга. Дозирование — 250–500 мг/кг/в неделю.
Доктора
Лекарства
- Антибиотики: Амосин, Амоксициллин, Флемоксин Солютаб, Амклав, Амоксиклав, Амоксиван, Амоксициллин+ Клавулановая кислота, Аквапенем, Гримипенем, Тиепенем, Ко-тримоксазол, Бисептол, Амбицеф, Винцепим, Вицеф.
- Иммуномодуляторы: Ронколейкин, Лейкинферон, Суперлимф, Лейкомакс, Беталейкин, Нейпоген, Циклоферон, Амиксин, Гриппферон, Герпферон, Виферон, Реаферон, Кипферон, Полиоксидоний, Глутоксим, Аллоферон, Галавит.
Процедуры и операции
К хирургическому лечению прибегают при бактериальных осложнениях: лимфадениты, абсцессы печени, почек, подкожной клетчатки, парапроктиты. При первичной иммунной недостаточности пациентам проводят трансплантацию стволовых клеток или вилочковой железы.
Диета при иммунодефицитах

Диета для повышения иммунитета
- Эффективность: лечебный эффект через 3 недели
- Сроки: 1-3 месяца и более
- Стоимость продуктов: 1600-1800 руб. в неделю

Диета 15 стол
- Эффективность: лечебный эффект через 2 недели
- Сроки: постоянно
- Стоимость продуктов: 1600-1800 рублей в неделю
За основу можно взять диету для повышения иммунитета, которая мало чем отличается от диеты 15 стола, но в ней увеличивается количество белка (нежирное мясо, творог, сыры) и клетчатки (овощи, фрукты, бобовые, листовая зелень). Для повышения иммунитета необходимы:
- Витамины A, C, D, B6 и E (цитрусовые, лук, чеснок, имбирь, орехи, растительные масла, куркума, ягодные смузи и морсы). Чемпион по содержанию омега-3 — грецкий орех, а в миндале много витамина Е.
- Минералы цинк, железо, селен и медь (рыба, яичный желток, цельнозерновые крупы, орехи, тыквенные семечки). Миндаль, грецкие орехи и кешью содержат селен и цинк, а яичный желток — селен.
- Омега-3 жирные кислоты (источники жирная рыба, орехи, печень трески).
- Пробиотики. Их содержат ферментированные овощи, натуральный йогурт и кефир, приготовленные на закваске, тофу, темпе, нут и чечевица. Также рацион можно дополнить пробиотиками в виде пищевых добавок.
Следует уменьшить/исключить жирную, острую пищу, сладкую выпечку и любые неполезные сладости (любые конфеты, печенье, вафли, сгущенное молоко).
Профилактика
Для профилактики первичных иммунодефицитов беременные должны избегать контакта с больными вирусными инфекциями и токсичными и радиационными веществами на производстве.
Для профилактики вторичного иммунодефицита необходимо:
- Устранение контакта с химическими и другими вредными профессиональными факторами.
- Исключение стресса.
- Нормализация сна и полноценный сон 7-8 часов.
- Регулярные физические нагрузки.
- Сбалансированное питание.
- Отказ от курения и приема алкоголя.
- Лечение заболеваний желудочно-кишечного тракта, учитывая то, что иммунитет зависит от микрофлоры кишечника и функции пищеварительной системы.
- Иммунопрофилактика инфекций. Вакцинация против пневмококка показана детям младше 2 лет, ВИЧ-инфицированным, страдающим диабетом, заболеваниями почек и печени и лицам старше 65 лет, имеющим риск заражения пневмококковой инфекцией. Большинство пациентов с ослабленным иммунитетом в возрасте 6 месяцев должны ежегодно вакцинироваться против гриппа.
Последствия и осложнения
- Развитие жизнеугрожающих инфекций. У таких больных страдает дыхательная система и они часто болеют пневмонией, бронхитами, бронхоэктатической болезнью. Тяжелые инфекционные осложнения становятся причиной смерти в младенчестве.
- Бактериальные осложнения: лимфадениты, абсцессы печени, почек, подкожной клетчатки.
- Развитие злокачественных опухолей.
Прогноз
По выраженности изменений иммунограммы составляют прогноз заболевания. Вторичные иммунодефицитные состояние развиваются в любом возрасте, прогноз при них чаще всего благоприятный и иногда встречается спонтанное выздоровление. При вторичных формах глубина дефектов в иммунном статусе незначительна (меньше 15–20% нормы). Легкие формы не требуют медикаментозного вмешательства, но пациенты не должны переохлаждаться, контактировать с больными вирусными инфекциями и периодически наблюдаться у педиатра или терапевта.
При средней выраженности изменений пациентам за три недели до сезонных вспышек вирусных инфекций назначают курс иммуномодулирующей терапии. Тяжелые формы первичной недостаточности иммунитета неизлечимы и при отсутствии адекватного лечения приводят ребенка к смерти. Некоторые формы успешно контролируются заместительной терапией, улучшая качество жизни пациента, но заместительная терапия должна проводиться пожизненно.
Список источников
- Клинические рекомендации Первичные иммунодефициты преимущественно с недостаточностью антител Федеральное государственное бюджетное учреждение «ГНЦ Институт иммунологии» ФМБА РФ, 2018, 41с.
- Чернышова Л.И. Вторичный иммунодефицит (иммунокомпрометированный пациент). Лекция/Здоровье ребенка, 2020, Том15, №6, С. 456–459.
- Современные методы диагностики первичных иммунодефицитов/Наука и инновации 2014, №6 (136), С. 12–15.
- Васильева М.М. Первичные иммунодефициты: общий вариабельный иммунодефицит/ Дальневосточный медицинский журнал, 2019, №3, С. 101-107.
- Стежкина ЕВ, Агапова АИ, Рыбакова ИЕ. Первичный иммунодефицит в практике врача педиатра — долгий диагноз в педиатрии? Аллергология и иммунология в педиатрии. 2022; 3: 55–56.





 Ронколейкин
Ронколейкин Циклоферон
Циклоферон Амиксин
Амиксин Ганцикловир
Ганцикловир Ацикловир
Ацикловир Амоксициллин
Амоксициллин Флемоксин Солютаб
Флемоксин Солютаб Амоксиклав
Амоксиклав Амоксициллин + Клавулановая кислота
Амоксициллин + Клавулановая кислота Ко-тримоксазол
Ко-тримоксазол Флуконазол
Флуконазол
















Последние комментарии
Людмила: Я пью квестран длительное время от хологенной диареи, скажите повышает ли препарат ...
Лилия: Где можно купить ма азь Проспидин
Гость: Напишите кто принимал инвермектин в уколах от паразитов, как рассчитывали дозу?
Мария: Посоветовала коллега, когда дочь болела, что ночью просыпалась и не могла спать из-за ...