Кардиомиопатия
Общие сведения
Среди заболеваний миокарда отдельно выделяются кардиомиопатии. Кардиомиопатия у взрослых является четвертой по частоте причиной развития хронической сердечной недостаточности. Что это такое кардиомиопатия? Это целая группа заболеваний миокарда, которые имеют не воспалительную и некоронарогенную (не связаны с поражением коронарных сосудов) природу. При заболевании возникают нарушения структуры сердечной мышцы и выраженные нарушения ее функции. Кардиомиопатии часто сопровождаются гипертрофией миокарда или расширением камер сердца. Данные заболевания развиваются вследствие различных причин и часто имеют генетическую природу.
Кардиомиопатии подразделяются на первичные (сюда относятся генетические, без установленной причины — идиопатическая кардиомиопатия, приобретенные, смешанные) и вторичные, развившиеся на фоне различных заболеваний. Первичная идиопатическая кардиомиопатия может быть дилатационной, гипертрофической, рестриктивной, аритмогенной дисплазией правого желудочка (болезнь Фонтана).
Идиопатическая форма дилатационной кардиомиопатии является самой тяжелой: заболевание у взрослых неуклонно прогрессирует, а дебютом его становится сердечная недостаточность. Кардиомиопатия смешанного генеза — это патология миокарда, которая имеет черты наследственно-обусловленного и приобретенного заболевания. Некоторые авторы относят в эту группу рестриктивную кардиомиопатию. Вторичная кардиомиопатия включает алкогольную, тиреотоксическую, диабетическую, дисгормональную, то есть вторичная развивается на фоне других заболеваний.
Патогенез
В следствие генных мутаций при гипертрофической КМП происходят специфические изменения в сердечной мышце — нарушение ориентации мышечных волокон, в результате чего сердечная мышца изменяется и утолщается. В основе патогенеза лежит повышение давления в левом желудочке в период диастолы (расслабления), в результате чего желудочек должен с повышенной силой изгонять кровь.
Увеличение нагрузки на сердечную мышцу вызывает еще большую гипертрофию и снижение податливости миокарда, а также уменьшение полости левого желудочка. Физическая нагрузка и тахикардия усиливают обструкцию выносящего тракта и нагрузку на левый желудочек. Предобморочные состояния и обмороки, характерные для этих больных, возникают в связи со снижением мозгового кровообращения и чаще отмечаются при физической нагрузке, как следствие малого сердечного выброса из-за уменьшенной полости желудочка.
Этиологию дилатационной КМП часто не удается установить, поэтому ее рассматривают как идиопатическую форму. Только 20% больных связывают данное заболевание с инфекционным миокардитом, перенесенным ранее. Считается, что повреждение митохондрий клеток, нарушение энергетического обмена в миокарде и отрицательное воздействие на миофибриллы (функциональная единица мышечного волокна), вызывают персистирующие в организме вирусы (прежде всего, энтеровирусы).
Вирусная РНК может включаться в генетический аппарат клеток миокарда, также вирусы «запускают» аутоиммунный процесс, что ведет к выраженным изменениям структуры миофибрилл и нарушению их сократительной функции. Отмечается также выраженная дистрофия кардиомиоцитов и их некроз. В результате таких патологических изменений сердечная мышца теряет способность к сокращению.
Патогенез рестриктивной КМП зависит от основного заболевания. При фибропластическом эндокардите основное значение имеют нарушения иммунного ответа и выделение активных веществ, которые повреждают кардиомиоциты. В последующем развивается фиброз и утолщение эндокарда. Фиброз влечет повышение жесткости миокарда в следствие чего нарушается диастолическая функция сердца. Нарушение расслабления уменьшает период наполнения желудочков, поэтому уменьшается ударный объем и увеличивается нагрузка на предсердия (они расширяются).
В патогенезе поражения сердца при алкогольной кардиомипатии отмечаются два механизма: пропитывание миокарда жировыми включениями, что вызывает дегенерацию клеток миокарда, и поражение миокарда и нервной системы в связи с дефицитом витамина В1. В связи с увеличением нагрузки на сердечную мышцу сначала развивается гипертрофия миокарда, затем липоматоз (пропитывание клеток жиром), дегенерация клеток, расширение полостей сердца, образование тромбов внутри полостей и развитие сердечной недостаточности. Алкогольная кардиомиопатия протекает с нарушением ритма и недостаточностью кровообращения и по большому, и по малому кругу. Прием алкоголя — провоцирующий фактор мерцательной аритмии.
Генез развития некомпактного миокарда до конца неясен. Имеется несколько точек зрения: нарушение эмбриогенеза и развитие патологии в процессе жизни. В период эмбриогенеза в норме происходит уплотнение губчатого слоя миокарда и формируется нормальный «компактный» слой — трубчатые мышечные волокна постепенно «срастаются». При нарушении этого процесса миокард сохраняет губчатую структуру, имеет глубокие пространства между трабекулами, которые соединяются с полостью ЛЖ. Если рассматривать приобретенную патологию в виде некомпактного миокарда, то можно отметить, что повышенная трабекулярность миокарда левого желудочка возникает у спортсменов, во время беременности и у больных серповидно-клеточной анемией. Увеличение трабекулярности в данных случаях рассматривается как адаптация к физической нагрузке и ответ на повышение нагрузки левого желудочка.
Классификация
Множество классификаций свидетельствует о том, что данная патология постоянно изучается и усовершенствуется. Каждая из приведенных классификаций дополняет одна другую.
По классификации 1995 г:
- Основные (дилатационная, гипертрофическая и рестриктивная).
- Дополнительные (аритмогенная, послеродовая).
- Специфические (дисметаболическая, ишемическая, воспалительная, гипертензивная, при системных заболеваниях, мышечные дистрофии, аллергические и токсические).
- Неклассифицированные (фиброэластоз, КМП на фоне митохондриопатий).
Классификация Американской ассоциации сердца 2006 г относится к первичным кардиомиопатиям и подразделяет их на:
- Генетические (сюда отнесена гипертрофическая, аритмогенная, митохондриальные миопатии, синдром некомпактного миокарда, гликогенозы, возникшие при нарушении функции ионных каналов).
- Смешанные (рестриктивная и дилатационная).
- Приобретенные (послеродовая, КМП такотсубо, при сахарном диабете и индуцированные тахикардией).
По рекомендациям Европейского общества кардиологов (от 2008г) выделяют основные формы:
- Дилатационная.
- Гипертрофическая.
- Рестриктивная.
- Аритмогенная правого желудочка.
- Неклассифицируемая (сюда отнесен некомпактный миокард и КМП такоцубо).
Гипертрофическая кардиомиопатия
Является генетически обусловленным заболеванием (доминируют семейные формы), которое распознается на поздней стадии, поскольку в 50-60% случаев обнаруживается при эхокардиографии случайно.
Проявляется в различном возрасте, что зависит от тяжести генного дефекта. Причина заболевания — мутации в генах саркомерных белков. С учетом генетического фактора часто применяется термин «семейная гипертрофическая кардиомиопатия». Заболевание является причиной внезапной смерти спортсменов в молодом возрасте.
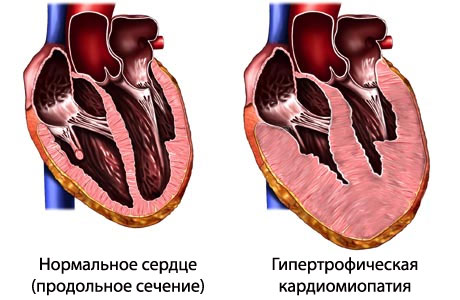
Гипертрофическая КМП характеризуется выраженной гипертрофией левого (больше 1,5 см) и/или правого желудочка, возникшей без причин (отсутствует предшествующее этому повышенное давление, наличие пороков и других заболеваний сердца). В процесс вовлекается межжелудочковая перегородка, верхушка и средние сегменты желудочка. Объём ЛЖ при этом может быть нормальным или уменьшенным. У 25% больных отмечается систолический градиент давления в левом желудочке, что обусловлено обструкцией (наличием преграды) выводного отдела левого желудочка.
В зависимости от наличия обструкции или отсутствия, кардиомиопатия имеет два гемодинамических варианта: гипертрофическая-обструктивная кардиомиопатия и необструктивная. Гипертрофическая — обструктивная КМП, которая подразумевает обязательное наличие обструкции выносящего тракта.
При этой форме возможны несколько вариантов обструкции:
- субаортальная обструкция постоянная и присутствует в покое, существует термин для определения этого состояния «мышечный субаортальный стеноз»;
- лабильная обструкция — присутствуют значительные колебания давления внутри желудочка;
- латентная — функциональная, появляется только при нагрузке или при проведении фармакологических проб.
Наличие обструкции определяет тяжесть клинических проявлений. Необструктивная КМП протекает с невыраженной гипертрофией миокарда и клиникой.
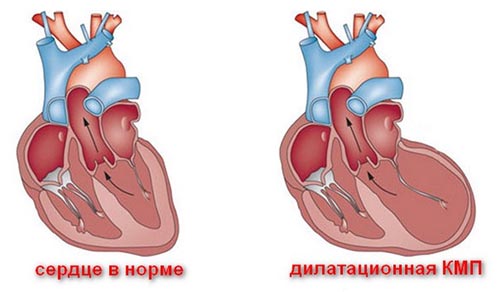
Дилатационная кардиомиопатия (ДКМП)
Чаще встречается у мужчин. Наиболее часто проявление ДКМП у человека регистрируется в 30-45 лет. Больные с этим заболеванием составляют до 55-60% всех больных с КМП. Для данного заболевания характерно расширение всех камер сердца и выраженное нарушение насосной функции сердца. При этом отсутствуют причины, которые могли бы вызвать такие нарушения сократительной функции сердца (патология клапанов, гипертензия, ИБС). Нарушение сократительной способности вызывает снижение выброса крови в систолу, а в желудочках увеличивается остаточный объем крови. Это приводит к расширению желудочков и развитию бивентрикулярной (лево- и правожелудочковой) сердечной недостаточности.
Различают следующие формы дилатационной КМП:
- Идиопатическая (развивается без явной причины и относится к редким заболеваниям).
- Семейная (наследственная, генетически обусловленная). У 40% больных заболевание имеет семейный характер.
- Вирусная и аутоиммунная. Отмечено, что дилатационная кардиомиопатия развивается на фоне перенесенного вирусного миокардита. Выявлена роль энтеровирусов Коксаки группы В.
Проявляется заболевание прогрессирующей сердечной недостаточностью. Осложняется аритмиями, тромбоэмболиями, которые возникают на любой стадии, возможна и внезапная смерть. Особенностью хронической сердечной недостаточности является тяжелое течение и неблагоприятный прогноз.
 Тромбозы и эмболии при данной форме КМП встречаются в 2-3 раза чаще, чем при прочих болезнях сердца. Пристеночные тромбы в левом желудочке при эхокардиографии находят в 40% случаев, частота тромбоза предсердий значительно выше и зависит от фибрилляции предсердий. Прогностически наиболее опасными считаются рецидивирующие тромбоэмболии в легочной артерии.
Тромбозы и эмболии при данной форме КМП встречаются в 2-3 раза чаще, чем при прочих болезнях сердца. Пристеночные тромбы в левом желудочке при эхокардиографии находят в 40% случаев, частота тромбоза предсердий значительно выше и зависит от фибрилляции предсердий. Прогностически наиболее опасными считаются рецидивирующие тромбоэмболии в легочной артерии.
Диагноз ДКМП устанавливается на основании:
- Рентгенологического исследования, которое указывает на увеличение сердца, повышенное внутрижелудочковое давление (о нем свидетельствует шаровидная форма сердца), признаки венозного застоя.
- Ультразвукового исследования сердца: дилатация полостей, нормальная или незначительно измененная толщина стенок, снижение фракции выброса и сократительной функции миокарда, недостаточность атриовентрикулярных клапанов, наличие тромбов в полостях сердца.
Код дилатационной кардиомиопатии по мкб-10-I42.0.
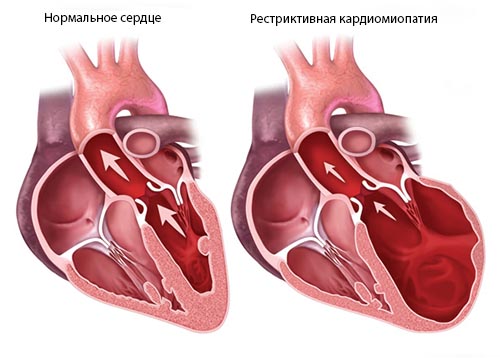
Рестриктивная кардиомиопатия
Редко встречающееся поражение сердечной мышцы, которое приводит к нарушению наполнения желудочков (одного или двух) во время диастолы и уменьшению объема их полостей. Полости предсердий увеличиваются. При этом изменения толщины миокарда отсутствуют. В стенке миокарда присутствует массивный фиброз (они становятся жесткими), и в процесс вовлекаются все камеры сердца. В связи с этим рестриктивная КМП включает несколько различных заболеваний, для которых характерно развитие фиброза:
- эндомиокардиальный фиброз;
- фибропластический эндокардит Леффлера;
- фиброэластоз новорожденных;
- африканская облитерирующая КМП.
 Рестриктивная КМП может быть связана с коллагенозами, неопластическими процессами и приемом противоопухолевых препаратов, последствиями локальной лучевой терапии. В тех случаях, когда рестриктивная КМП формируется без патологии сердечных клапанов, перикарда и эпикарда, ставится диагноз «идиопатическая рестриктивная кардиомиопатия». Заболевание протекает или бессимптомно, или беспокоят приступы удушья, потеря сознания при физических нагрузках и частые легочные инфекции.
Рестриктивная КМП может быть связана с коллагенозами, неопластическими процессами и приемом противоопухолевых препаратов, последствиями локальной лучевой терапии. В тех случаях, когда рестриктивная КМП формируется без патологии сердечных клапанов, перикарда и эпикарда, ставится диагноз «идиопатическая рестриктивная кардиомиопатия». Заболевание протекает или бессимптомно, или беспокоят приступы удушья, потеря сознания при физических нагрузках и частые легочные инфекции.
Это связано с тем, что у некоторых больных диастолическая дисфункция появляется в ранние сроки и выражена, поэтому рано возникают жалобы и признаки сердечной недостаточности. В других случаях диастолическая дисфункция не имеет клинических проявлений, поэтому состояние больных не ухудшается многие годы.
К неклассифицированным КМП согласно классификации 2008 г относится некомпактный миокард, вернее синдром некомпактного левого желудочка, поскольку он чаще поражается, и кардиомиопатия такоцубо.
Некомпактная кардиомиопатия левого желудочка — гетерогенное (одно и то же заболевание вызывается мутациями в разных генах) заболевание, которое характеризуется ненормальным двуслойным строением миокарда. Первый слой представлен нормальным по строению компактным миокардом, а второй имеет губчатую структуру с трабекулами и пространствами между ними, которые сообщаются с полостью левого желудочка (он поражается чаще).
Соотношение некомпактного и компактного слоя 2:1. То есть некомпактный миокард широкий, а слой истинного миокарда истонченный и практически нефункциональный. Такое строение миокарда вызывает ухудшение сократительной функции желудочка, которое прогрессирует и быстро развивается фатальная сердечная недостаточность, желудочковые аритмии и системные тромбоэмболии. С внедрением генетических методов исследования появилась возможность ранней диагностики. У 50% больных эта патология выявляется в семье. Чаще наблюдаются мутации в генах саркомеров — такие мутации обнаруживаются и при дилатационной и при гипертрофической КМП.
Кардиомиопатия такоцубо
Основу кардиомиопатии такоцубо (или стрессорной КМП, «синдрома разбитого сердца») составляет острое воспаление миокарда, возникшее на фоне массивного выброса катехоламинов (адреналин, дофамин и норадреналин). Возникает заболевание чаще у женщин после тяжелого стресса. При этом формируется остро развивающаяся систолическая дисфункция ЛЖ (нарушения сократимости).
В типичных случаях у больных возникает острый коронарный сидром (инфаркт миокарда): интенсивная боль в грудной клетке, одышка, выраженная тахикардия, признаки инфаркта на электрокардиограмме, но симптоматика может разрешиться через несколько суток. У многих возникают осложнения: отек легких, аритмии, разрыв стенки ЛЖ, артериальная гипотензия и смерть. Также возможны осложнения в виде инсультов (ишемический или геморрагический). Частое осложнение раннего периода — шок.
Специфические кардиомиопатии включают дисметаболическую (метаболическую), ишемическую, клапанную, гипертензивную, аллергическую/токсическую (алкогольная, лекарственная, радиационная), КМП при коллагенозах и мышечную дистрофию.
Ишемическая кардиомиопатия
Данный вид КМП рассматривается как форма ишемической болезни сердца. Кардиомиопатия этого типа возникает на фоне распространенного и выраженного атеросклероза магистральных, коронарных артерий и перенесенного инфаркта миокарда. Патологическое состояние миокарда развивается в результате постоянных приступов ишемии миокарда. Частые и длительные эпизоды ишемии вызывают дегенеративные изменения в миоцитах и их гибель.
Ишемическая КМП встречается в возрасте 45-55 лет, преимущественно среди мужчин. В становлении данной кардиомиопатии важная роль отводится постинфарктному ремоделированию (изменению) миокарда и его гибернации. Гибернация — это адаптивный процесс снижения сократительной функции сердца пропорционально снижению кровотока. Это позволяет предупредить дальнейшее развитие ишемии в миокарде и развитие острого инфаркта миокарда. Сниженная сократительная функция полностью нормализуется при восстановлении нормального кровоснабжения.
Ишемическая кардиомиопатия протекает с расширением полостей сердца (прежде левого желудочка, потом и других камер), истончением стенок левого желудочка и значительной кардиомегалией, все это приводит к выраженному нарушению насосной функции сердца и хронической сердечной недостаточности.
Ремоделирование желудочка происходит медленно с включением компенсаторных механизмов, при которых постепенно увеличиваются камеры сердца. Сердечная недостаточность также прогрессирует медленно, начинаясь с левожелудочковой, а на поздних стадиях присоединяется и правожелудочковая.
Характерные признаки этой КМП — увеличение массы сердца, бивентрикулярное расширение, тяжелое атеросклеротическое поражение коронарных артерий и непропорциональное истончение стенок желудочка (толщина неизмененной мышечной ткани не более 11 мм). Диагноз КМП свидетельствует о длительном анамнезе и распространенном поражении коронарных сосудов, поэтому основной метод исследования — коронароангиография.
Метаболическая кардиомиопатия
Метаболическая кардиомиопатия, что это такое? Данная группа кардиомиопатий объединяет заболевания сердечной мышцы, возникшие на фоне нарушенного в организме обмена веществ. Синонимом является дисметаболическая кардиомиопатия и относится к классу дилатационной КМП. Код дисметаболической кардиомиопатии по мкб-10-I43.1 (кардиомиопатия при метаболических нарушениях). Пожалуй, это самая большая группа вторичных поражений миокарда, поскольку вызывается разными и многочисленными причинами:
- Эндокринная патология (тиреотоксикоз, феохромоцитома, гипотериоидизм, сахарный диабет, акромегалия, ожирение).
- Наследственные болезни накопления: болезнь Немана-Пика, Хурлера, Фабри, гемохроматоз, болезни накопления гликогена.
- Дефицит электролитов (калия, магния, селена, железа, витаминов группы В).
- Амилоидоз — сложные обменные изменения, в результате которых отмечается отложение белков (амилоидов) в тканях.
- Интоксикации (лекарственная, алкогольная, эндотоксикоз при различных заболеваниях).
- Гормональные перестройки (климакс естественный и искусственный).
- Негативное действие окружающей среды (радиация, переохлаждения и прочее).
- Стрессовые ситуации.
Из вторичных кардиомиопатий, возникших на фоне эндокринной патологии, следует выделить:
- Тиреотоксическая кардиомиопатия. На фоне тяжелого некомпенсированного тиреотоксикоза при диффузном токсическое зобе развивается дилатационная КМП, недостаточность клапанов (митрального и трехстворчатого), мерцательная аритмия и недостаточность кровообращения. Кардиомиопатия проходит три стадии: миокардиодистрофия и гипертрофия сердечной мышцы (они имеют обратимый характер, если правильно проводится лечение); компенсаторная гипертрофия и расширение полостей (изменения частично обратимы); миокардиосклероз, который свидетельствует о необратимых изменениях и влечет развитие сердечной недостаточности. Задача лечения тиреотоксикоза — достижение эутиреоидного состояния, для чего назначаются тиреостатики, которые блокирует синтез гормонов железой. При лечении тиреостатиками ликвидируются признаки недостаточности кровообращения при ДКМП в покое, исчезает мерцательная аритмия, увеличивается фракция выброса и даже нормализуются размеры полостей сердца. Параллельно назначаются b-адреноблокаторы.
- Акромегалия характеризуется избыточной выработкой соматотропного гормона и ИРФ-1, которые активно воздействуют на кардиомиоциты. Среди сердечно-сосудистых нарушений при акромегалии отмечается гипертрофия миокарда, интерстициальный фиброз и акромегалическая кардиомиопатия, основным фактором риска которой является длительность заболевания.
Дисгормональная кардиомиопатия (климактерическая)
Некоторые авторы выделяют в отдельную нозологию. Однако по МКБ-10 она относится к дисметаболической и имеет один код — I43.1 (кардиомиопатия при метаболических нарушениях).
Дисгормональная КМП связана с нарушением активности эстрогенов, которые благоприятно влияют на электролитный и белковый обмен в миокарде и регулируют влияние симпатической нервной системы на сердце. Заболевание развивается при дефиците эстрогенов в климактерический период и у молодых женщин с гинекологическими заболеваниями (миома, эндометриоз), при предменструальном синдроме посткастрационном. При патологическом климаксе в сердечной мышце развиваются метаболические нарушения, которые влекут дистрофические изменения, в большинстве случаев имеющие обратимый характер. Только у некоторых женщин они заканчиваются миокардиофиброзом. Данная форма кардиомиопатии может остро возникнуть и развиться постепенно.
Наиболее часто женщины жалуются на продолжительные боли в области сердца, имеющие разнообразный характер. Отличительной особенностью является то, что кардиалгии не провоцируются физической нагрузкой, могут длиться несколько дней и не устраняются приемом нитроглицерина. У женщин появляются вегетативные расстройства: сердцебиение, головокружение, неудовлетворенность вдохом и «недостаток воздуха» даже в состоянии покоя, приливы. Характерны колебания давления и общая невротизация.
При климактерической КМП могут быть следующие нарушения ритма:
- желудочковая экстрасистолия;
- синусовая аритмия;
- суправентрикулярная тахикардия.
При обследовании выявляется несоответствие — масса кардиологических жалоб при отсутствии признаков коронарной или сердечной недостаточности.
Токсическая кардиомиопатия
Токсическую КМП вызывает воздействие лекарственных препаратов, токсичных веществ на производстве и злоупотребление алкоголем. Выявлено, что у большинства пациентов, которые в своей профессиональной деятельности подвергались постоянному и продолжительному воздействию ксенобиотиков (чужеродные для организма химические вещества), развивалась кардиомиопатия, которая имела характер дилатационной.
Под действием ксенобиотиков в кардиомиоцитах развивается дистрофия и некроз одних клеток, а, как следствие, компенсаторная гипертрофия других. В интерстиции миокарда возникали: отек и фиброз, отмечается склероз эндокарда. Все эти процессы влекут гипертрофию стенок и дилатацию камер сердца. Часто в камерах сердца обнаруживаются пристеночные тромбы, которые становились причиной смерти. При этом у больных отсутствуют изменения в коронарных сосудах.
Токсическая кардиомиопатия развивается также на фоне эндотоксикоза, например уремическая кардиомиопатия. При уремии паратиреоидный гормон выделяется в повышенных концентрациях и становится «универсальным уремическим токсином». При этом очень рано нарушается тканевой обмен, а продукты нарушенного обмена белков и липидов вторично повреждают сердечную мышцу. В ней меняется содержание белка и липидов, снижается активность тканевых ферментов, происходят изменения в ДНК и РНК. Токсические продукты вызывают также сосудистые нарушения, которые в дальнейшем поддерживают процессы повреждения кардиомиоцитов. При хроническом эндотоксикозе изменения в сердечной мышце относятся к разновидностям дисметаболической КМП.
Примером воздействия медикаментов является нейролептическая кардиомиопатия. Прием кардиотоксичных фенотиазиновых нейролептиков (Аминазин, Тизерцин, Трифтазин, Этаперазин, Неулептил, Сонапакс) приводит ко вторичным токсическим (метаболическим) кардиомиопатиям, которые по форме относятся к дилатационным. Отмечается диффузное поражение миокарда, выраженное снижение его сократительной функции и прогрессирующая ХСН.
 Алкоголизм — это заболевание, для которого характерна совокупность психических и соматических расстройств. Чаще всего при алкоголизме поражается печень и сердце. Алкогольная кардиомиопатия относится к вторичной токсической дилатационной кардиомиопатии. В МКБ-10 алкогольная КМП выделена в отдельную форму — I 42.6. Заболевание развивается при злоупотреблении алкоголем на протяжении 10 лет. В последнее время отмечается четкая тенденция к сокращению этого срока. Выраженная сердечная недостаточность, развившаяся на фоне КМП, тромбоэмболии и нарушения ритма не редко вызывают смерть.
Алкоголизм — это заболевание, для которого характерна совокупность психических и соматических расстройств. Чаще всего при алкоголизме поражается печень и сердце. Алкогольная кардиомиопатия относится к вторичной токсической дилатационной кардиомиопатии. В МКБ-10 алкогольная КМП выделена в отдельную форму — I 42.6. Заболевание развивается при злоупотреблении алкоголем на протяжении 10 лет. В последнее время отмечается четкая тенденция к сокращению этого срока. Выраженная сердечная недостаточность, развившаяся на фоне КМП, тромбоэмболии и нарушения ритма не редко вызывают смерть.
Для некоторых кардиомиопатий (дилатационной и семейной форм кардиомиопатий) характерна кардиомегалия, что означает «большое сердце». Сердце увеличивается в размерах за счет гипертрофии сердечной мышцы и расширения полостей. Часто для определения этого состояния применяется метафорический термин «бычье сердце», который только отражает наглядный, внешний вид органа. Не совсем верен термин «болезнь бычье сердце», поскольку такого заболевания не существует. Это синдром, который наблюдается при различных заболеваниях и состояниях:
- врожденных пороках сердца;
- системных коллагенозах;
- вирусных миокардитах,
- полицитемии;
- артериовенозных анастомозах;
- эритродермии;
- болезни Педжета;
- постоянных чрезмерных нагрузках у спортсменов;
- злоупотреблении пивом.
Кардиомегалия может развиться также на фоне приема некоторых медикаментов (Даунорубицин, Эметин, трициклические антидепрессанты, фенотиазиновые нейролептики, сульфаниламидные препараты). В силу различных причин увеличение сердца является компенсаторным — оно работает в усиленном режиме, перекачивая больший объем крови и увеличивается, а камеры расширяются.
Например, при аортальных пороках в сердце происходит выраженная рабочая гипертрофия левого желудочка. Он может быть величиной с человеческую голову. Масса сердца при недостаточности аортального клапана может достигать 900 г и более. Несмотря на то, что размеры органа увеличены, объём функционирующей массы значительно снижается. Мышечные клетки замещаются соединительной тканью, миокард становится дряблым и слабым, при этом сердце снижает свою насосную функцию и развивается сердечная недостаточность.
Причины
Причины заболеваний различны и среди основных следует выделить:
- Генетические факторы. Например, при гипертрофической КМП описаны 200 мутаций нескольких генов, которые кодируют белки миофибрилл.
- Наследственные болезни накопления.
- Вирусные заболевания.
- Эндокринная патология.
- Дефицит электролитов.
- Амилоидоз.
- Токсическое воздействие (алкоголь, пестициды, ксенобиотики, избыточное поступление кобальта).
- Эндотоксикоз.
- Прием медикаментов (противоопухолевые, нейролептики, сульфаниламиды
- Гормональные изменения.
- Воздействие окружающей среды (в том числе облучение).
- Стрессовые ситуации.
Симптомы кардиомиопатии
Клиническая картина всех кардиомиопатий включает:
- Признаки сердечной недостаточности.
- Нарушения ритма и проводимости.
- Тромбоэмболические осложнения.
Некоторые виды имеют присущие только им отличительные особенности клиники.
Симптомы гипертрофической КМП
Больных беспокоит быстрая утомляемость, одышка при физической нагрузке и в покое, боли в сердце и ночные приступы сердечной астмы. Боли в области сердца носят ангинозный характер — сжимающее-давящие за грудиной, возникающие после физической нагрузки. По продолжительности они дольше, чем при стенокардии напряжения.
Боли в сердце обусловлены уменьшением доставки кислорода при увеличенной потребности в кислороде. Специфическим симптомом являются предобморочные и обморочные состояния, которые наблюдаются у 77% больных. Они обусловлены аритмиями (характерны желудочковые экстрасистолы, которые являются самым ранним симптомом), выраженной гипотонией и нарушением кровоснабжения мозга. Частота обмороков значительно варьирует у разных больных: от ежедневных и частых до единичных, появляющихся раз в несколько месяцев. Чаще обмороки бывают у пациентов, имеющих обструкцию выносящего тракта.
Выделяются несколько вариантов течения заболевания:
- Стабильное и доброкачественное.
- Прогрессирующее — с течением времени все симптомы становятся выраженными в виду прогрессирования сердечной недостаточности.
- Внезапная смерть.
- Развитие фибрилляции предсердий и осложнений в виде тромбоэмболий.
Проявления дилатационной кардиомиопатии
Жалобы больных неспецифичны и связаны с сердечной недостаточностью: слабость, утомляемость, одышка, головокружение, отеки ног, кашель, увеличение живота (асцит), сердцебиение и аритмии. Характерно сочетание желудочковых и наджелудочковых экстрасистол, которые переходят в мерцательную аритмию. Также развиваются тромбоэмболии, источником которой являются тромбы в расширенных полостях сердца. Часто дилатационная КМП проявляется остро и внезапно без причины или после вирусной инфекции, перенесенной пневмонии или родов. У таких больных развивается левожелудочковая и правожелудочковая недостаточность.
Симптомы рестриктивной кардиомиопатии
Для ранних стадий характерно появление слабости и приступообразной одышки ночью. На поздних стадиях развивается застойная сердечная недостаточность с увеличением печени, асцитом и набуханием вен шеи. Больные жалуются на выраженную одышку при малейшей нагрузке, тяжесть в правом подреберье, отеки, увеличение живота. Состояние больных тяжелое и отмечается несоответствие между выраженностью сердечной недостаточности и отсутствием увеличения сердца. Увеличение полостей предсердий создает условия для появления суправентрикулярных нарушений ритма: предсердные аритмии и мерцательная аритмия в сочетании с блокадами.
Симптомы алкогольной кардиомиопатии
Симптомы неспецифичны и свидетельствуют о хронической сердечной недостаточности: одышка, застой в легких, отеки, расширение вен шеи. Часто отмечаются аритмии, реже — тромбоэмболии. Сердечная недостаточность в 3% случаев становится причиной смерти. В клинической картине данных больных на первый план выступает панкреатит, печеночная недостаточность, полинейропатии за счет значимого дефицита витамина В1.
Анализы и диагностика кардиомиопатии
Диагностика любых форм кардиомиопатий включает:
- эхокардиографическое исследование;
- рентгенологическое исследование;
- ЭКГ;
- холтеровское мониторирование ЭКГ.
Диагностика гипертрофической кардиомиопатии
Основывается на эхокардиографическом исследовании, но «золотым» стандартом диагностики является выявление мутации генов, поскольку отдельные мутации связывают с неблагоприятным прогнозом и высоким риском внезапной смерти. При мутации в гене тропонина Т у больного развивается умеренная гипертрофия, но прогноз неблагоприятен и высокая вероятность внезапной смерти. Другие генетические мутации сопровождаются более благоприятным течением и прогнозом.
Классические эхокардиографические признаки ГКМП:
- Асимметричная гипертрофия межжелудочковой перегородки (обычно более 13 мм). Гипертрофированный участок обнаруживается на перегородке и свободной стенке. Реже отмечается поражение одной только перегородки.
- Гипокинезия гипертрофированного участка (чаще межжелудочковой перегородки).
- Небольшой размер и объем левого желудочка.
- Внутрижелудочковый градиент давления более 30 мм рт. ст. в состоянии покоя (при нагрузке – больше 50 мм рт. ст.).
- Пролапс митрального клапана и митральная недостаточность.
- Систолическое движение митрального клапана.
- Систолическое прикрытие аортального клапана.
На электрокардиограмме при ГКМП — признаки гипертрофии левого желудочка, глубокие зубцы Q, подъем сегмента SТ, в левых грудных отведениях — отрицательные зубцы Т. Последний признак может свидетельствовать о гипертрофии миокарда в области верхушки. При холтеровском мониторинге определяются аритмии (чаще желудочковые и предсердные).
Обследования при ДКМП
Рентгенологическое исследование — это первый шаг, который позволяет заподозрить эту патологию. Выявляется увеличение сердца, признаки повышенного давления внутри желудочков и признаки венозного застоя. При эхокардиографии определяется расширение полостей сердца при почти неизменной толщине стенок, снижение сократительной способности и фракции выброса, недостаточность предсердно-желудочковых клапанов, тромбы в полости желудочков. Для подтверждения диагноза проводится стресс ЭХО-КГ с добутамином, если необходимо — эндомиокардиальная биопсия и ангиография.
Диагностика рестриктивной КМП
При ЭхоКГ исследовании:
- отсутствуют дилатация и гипертрофия желудочков;
- не нарушена сократительная функция сердца;
- полости желудочков могут уменьшаться;
- наличие пристеночных тромбов;
- определяется недостаточность двустворчатого и трехстворчатого клапана за счет увеличения предсердий;
- при исследовании трансмитрального потока определяется рестриктивный тип диастолической функции.
Лечение кардиомиопатии
Лечение различных видов кардиомиопатий отличается. Но в целом оно направлено на уменьшение проявлений сердечной недостаточности, устранение аритмий и профилактику тромбоэмболических осложнений.
Лечение дилатационной кардиомиопатии
Нужно отметить, что лечение дилатационной КМП с сердечной недостаточностью предусматривает пожизненный прием ингибиторов ангиотензинпревращающего фермента (Каптоприл, Лизиноприл, Периндоприл, Рамиприл, Фозиноприл) и β-адреноблокаторов, отмена которых сопровождается ухудшением состояния больного. Причем назначение первой группы препаратов обеспечивает улучшение прогноза заболевания. По показаниям назначаются мочегонные средства, сердечные гликозиды и периферические вазодилататоры — они не влияют на прогноз, но положительно влияют на симптомы заболевания.
Доказана эффективность следующих β-блокаторов в лечении сердечной недостаточности: метопролола, небиволол, бисопролола, карведилола. При выраженной сердечной недостаточности назначается карведилол, который влияет на снижение смертности больных.
Диуретики назначают только при задержке жидкости, поскольку они оказывают побочные эффекты, неблагоприятно влияющие на течение сердечной недостаточности. При застойной сердечной недостаточности мочегонные препараты назначают двумя этапами: активная диуретическая терапия, которая устраняет задержку жидкости, отеки, застой в легких, асцит и поддерживающая терапия — ежедневный прием минимальной дозы.
Сердечные гликозиды по современным стандартам принимают длительно в малых дозах — Дигоксин 0,125-0,25 мг в день. Доказано, что более высокие дозировки увеличивают риск появления аритмий. При мерцательной аритмии дозу увеличивают до 0,5 мг. Дигоксин назначают вместе с мочегонными, β-блокаторами и ИАПФ.
Учитывая частое развитие тромбоэмболий важным направлением лечения является антикоагулянтная терапия. Чаще используются непрямые антикоагулянты (Варфарин).
Есть данные в пользу того, что при идиопатической дилатационной КМП прием гормона роста улучшает функцию сердца и оказывает противовоспалительное действие. В одном исследовании препарат вводился по 4 МЕ через день в течение трех месяцев и получены такие результаты. Возможно, гормон роста будет рекомендован в виде иммуномодулирующей терапии для улучшения гемодинамики.
Установлена также роль L-карнитина для энергообеспечения кардиомиоцитов. Концентрация L-карнитина снижается при недостаточности кровообращения и ишемии. У взрослых с выраженной сердечной недостаточностью (III и IV ФК) применение этого препарата увеличивало продолжительность жизни. Показан эффект применения его при кардиомиопатиях у детей.
Лечение алкогольной КМП
Основные принципы лечения сердечной недостаточности такие же, но терапия данной КМП имеет некоторые особенности:
- Показано введение высоких доз тиамина. Дефицит тиамина — единственный фактор, роль которого в развитии КМП алкогольного генеза доказана.
- При мерцательной аритмии для урежения ритма назначаются β-блокаторы, а не сердечные гликозиды. Последние усиливают у этих больных аритмию.
- Петлевые диуретики усиливают гипокалиемию, которая имеется у таких больных, и провоцируют нарушения ритма.
- Вспомогательная терапия — поддержка и коррекция метаболизма (Рибоксин, АТФ, Панангин, Милдронат, Триметазидин, Кокарбоксилаза, Карнитин, Ранолазин, Этомоксир). Милдронат и Триметазидин снижают уровень продуктов перекисного окисления липидов в крови.
Лечение гипертрофической кардиомиопатии
С учетом того, что гипертрофическая КМП имеет наследственный характер, лечение преимущественно симптоматическое. Оно проводится в следующих направлениях:
- симптоматическая терапия для устранения аритмии, ишемии, сердечной недостаточности;
- воздействие на нейрогуморальные системы, которые способствуют прогрессированию гипертрофии;
- профилактика внезапной смерти.
Некоторые авторы считают, что при бессимптомной или малосимптомной форме заболевания нет необходимости в лечении. Другие придерживаются мнения, что использование у этой группы пациентов β-адреноблокаторов и антагонистов кальция может сдерживать появление клинической симптоматики и нарушений кровообращения.
Выжидательная тактика возможна только при отсутствии обмороков, обструкции и нарушений ритма. Для симптоматической терапии рекомендуют применение β-адреноблокаторов и антагонистов кальция (Верапамил, Дилтиазем). Приоритет отдают β-адреноблокаторам. Для лечения нарушений сердечного ритма, которые очень часто встречаются при этой форме, используются Ритмодан и Амиодарон.
β-адреноблокаторы остаются наиболее эффективными препаратами, которые применяются в лечении гипертрофической КМП, поскольку эффективно устраняют одышку, сердцебиение, стенокардические боли, так как уменьшают потребность сердечной мышцы в кислороде. Поскольку эта группа препаратов подавляет активность симпатоадреналовой системы, предотвращается повышение субаортального градиента давления при латентной и лабильной обструкции. За счет уменьшения ЧСС и предупреждения ишемии β-блокаторы улучшают наполнение ЛЖ. Имеются данные в пользу того, что данная группа препаратов сдерживает развитие гипертрофии и даже приводит к ее обратному развитию.
Из β-блокаторов при этой форме КМП предпочтение отдается Обзидану или Анаприлину. Их назначают 20 мг трижды в день, увеличивая дозу до максимальной (бывает даже 120–240 мг/сут). Отсутствие эффекта от приема β-блокаторов связано с недостаточной дозировкой. Существует мнение, что кардиоселективные β-блокаторы (Атенолол, Конкор) не имеют преимуществ перед неселективными, поскольку их нужно принимать в высоких дозах и селективность почти утрачивается.
При тяжелых суправентрикулярных и желудочковых аритмиях назначают препарат Соталол (сочетает действие β-блокатора и антиаритмическое).
Применение блокаторов кальциевых каналов устраняет несинхронное сокращение миокарда, приостанавливает развитие гипертрофии, улучшает расслабление миокарда. Среди блокаторов кальциевых каналов предпочтение отдается Верапамилу (Изоптин, Финоптин). При его приеме повышается переносимость нагрузки и снижение субаортального градиента давления.
Поскольку у больных отмечается активация ренин-ангиотензиновой систем, в связи с этим целесообразно применение ингибиторов АПФ у пациентов с необструктивной формой и симметричной гипертрофией миокарда. Но препараты этой группы не назначаются при обструктивной форме, поскольку могут усиливать обструкцию. При гипертрофической КМП не назначаются нитраты и сердечные гликозиды, поскольку они усиливают обструкцию.
Особенности лечения КМП такоцубо
С учетом того, что КМП такоцубо — острое состояние, в лечении применяют следующие подходы:
- вводят антикоагулянты (гепарин) для уменьшения тромбообразования;
- постоянное мониторирование сердечных аритмий;
- исключают из лечения катехоламины и органические нитраты;
- назначают ингибиторы ангиотензинпревращающего фермента — они при длительном приеме снижают риск повторных приступов.
Доктора
Лекарства
- β-адреноблокаторы: Бисопролол, Бетаксолол, Метопролол, Атенолол, Конкор, Карведилол, Нибиволол, Соталол.
- Блокаторы кальциевых каналов: Верапамил, Дилтиазем, Кардил.
- Ингибиторы ангиотензин превращающего фермента: Каптоприл, Лизиноприл, Периндоприл, Рамиприл, Фазиноприл.
- Противоаритмические: Амиодарон, Пропафенон.
- Сердечные гликозиды: Дигоксин.
- Периферические вазодилататоры: Нитроглицерин, Нанипрус, Апрессин.
- Антикоагулянты: Варфарин, Гепарин.
Процедуры и операции
Из оперативных методов лечения гипертрофической КМП можно назвать:
- имплантация дефибриллятора (при высоком риске внезапной смерти);
- двухкамерная сихронизированная AV-стимуляция (имплантация электрокардиостимулятора при нарушениях проводимости);
- миотомия/миоэктомия (уменьшение толщины гипертрофированного миокарда хирургическим путем);
- обтурация межжелудочковой артерии введением в нее этилового спирта; в результате процедуры в участке миокарда и межжелудочковой перегородки развивается некроз с рубцеванием, что способствует уменьшению толщины участка;
- трансплантация сердца (при значительном уменьшении полости желудочка, выраженной гипертрофии и развитии тяжелой сердечной недостаточности).
Трансплантация сердца — радикальный метод лечения терминальной сердечной недостаточности, которую не удается корректировать ни медикаментозным ни хирургическим путем. Основным показанием к ее проведению является тяжелая недостаточность кровообращения, которая развивается при дилатационной кардиомиопатии.
Операция по трансплантации органа сопряжена с различными осложнениями в посттрансплантационном периоде:
- Послеоперационная инфекция, которая стоит на первом месте среди осложнений. Среди вирусов инфекционный процесс чаще всего вызывают вирус Эпштейна–Барр, вирус простого герпеса и цитомегаловирус. Считается, что цитомегаловирус играет роль в развитии реакции отторжения и патологии коронарных артерий. Для профилактики длительное временя проводится противовирусное лечение. Кандидозы и аспергилезы вызывают тяжелую пневмонию.
- Артериальная гипертензия.
- Патология коронарных артерий. Это основная причина смерти после операции. Проявлениями этой патологии является безболевая ишемия и внезапная смерть.
- Хроническое отторжение донорского органа.
У детей
Если у взрослых основными причинами хронической сердечной недостаточности являются гипертоническая болезнь и ИБС, то в детском возрасте наиболее часто она развивается при кардиомиопатии. Среди кардиомиопатий наиболее часто встречается дилатационная (80,2%), реже — рестриктивная кардиомиопатия. Кардиомиопатия у детей относятся к тяжелым заболеваниям, непрерывно прогрессирующим и имеющим высокую смертность. У новорожденных и детей до шести месяцев причиной внезапной смерти являются врожденные пороки сердца, а на втором году жизни — кардиомиопатии.
Дилатационная кардиомиопатия характеризуется увеличением полостей чаще левых отделов и при этом отсутствует гипертрофия миокарда. У ребенка уменьшается сердечный выброс из-за значительного снижения сократительной функции миокарда. Встречается у детей всех возрастов. У заболевших в раннем возрасте (часто после ОРВИ), протекает остро с явлениями левожелудочковой сердечной недостаточности и наличием гидроперикарда, которой определяется при эхокардиографии. У детей более старшего возраста развивается без видимых причин и постепенно, протекает с бивентрикулярной сердечной недостаточностью, наличием аритмий и тромбоэмболий.
При дилатационной кардиомиопатии в детском возрасте возможны варианты течения: благоприятное, медленно прогрессирующее (чаще всего), быстро прогрессирующее и рецидивирующее (также достаточно часто). Благоприятное течение встречается у детей, которые заболели до 2-х лет, а прогрессирующее — у заболевших в старшем возрасте.
Лечение детей с хронической сердечной недостаточностью включает бета-адреноблокаторы, ИАПФ, диуретики, по показаниям — сердечные гликозиды. Бета-адреноблокаторы не рекомендуется назначать больным в состоянии декомпенсации, их добавляют к лечению после устранения отеков. При гипотонии в комплекс лечения включаются стероидные гормоны. Дети с кардиомиопатиями должны постоянно находиться под наблюдением и периодически госпитализироваться для проведения коррекции лечения с учетом изменившихся проявлений заболевания.
Причины кардиомиопатии у детей различны:
- Генные или хромосомные нарушения, влекущие нарушения обмена. У детей гораздо чаще чем у взрослых причиной этого заболевания являются генетически обусловленные врожденные метаболические дефекты.
- Вирусная инфекция, перенесенная во время беременности (например, краснуха) или ребенком.
- Воздействие негативных факторов среды.
- Прием во время беременности тератотоксичных препаратов или наркотиков. Воздействие негативных факторов в период закладки сердечно-сосудистой системы (вторая-восьмая неделя беременности) неблагоприятно сказывается на формировании сердца.
Большое значение имеет генетическое тестирование. Например, важно выявление мутации в генах, ответственных за развитие гипертрофической кардиомиопатии или мутаций в гене GLA (болезнь Фабри).
Поражения сердечно-сосудистой системы при болезни Фабри проявляются гипертрофической кардиомиопатией (преимущественная гипертрофия левого желудочка), нарушениями ритма и сердечной недостаточностью. Это наследственное заболевание, которое относится к группе лизосомных болезней накопления. Характеризуется отсутствием фермента α-галактозидазы А или снижением его активности.
Дефицит фермента влечет накопление гликофосфолипидов в лизосомах сердца, эндотелия сосудов, почек и нервной системы. Заболевание провялятся болями в конечностях (кисти и стопы), слабостью, появлением ангиокератом (сосудистые образования кожи), поражением сердца и почек, возможны ишемические атаки и инсульт. Стандартом диагностики данного заболевания является определение активности фермента α-галактозидазы А. Его активность снижается в плазме, лейкоцитах, в любом биоптате или слезной жидкости. Диагноз может быть установлен пренатально. Исследуется активность фермента αGAL в плазме плода или культуре ворсин хориона или амниона.
Синдром Гюрлера также, как и болезнь Фабри относится к болезням накопления. Это тяжелая форма мукополисахаридоза 1 типа. Этот синдром связан с мутациями в гене IDUA, что приводит к отсутствию фермента альфа-L-идуронидазы, в результате чего в лизосомах накапливается дерматансульфат и гепарансульфат. Характеризуется данный синдром скелетными деформациями, пороками сердца, увеличением печени, нарушениями дыхания и познавательной функции, характерным видом ребенка.
Генетическое исследование доступно. Пренатальная диагностика возможна — измеряется ферментативная активность в ворсинах хориона или амниоцитах. Больным рекомендуется трансплантация гемопоэтических стволовых клеток и пожизненная ферментозаместительная терапия Ларонидазой.
Болезнь Помпе тоже относится к болезням накопления. Развивается в связи с нарушением метаболизма, которое обусловлено дефицитом фермента кислой альфа-глюкозидазы (он необходим для метаболизма гликогена в мышцах, сердце и печени). Накопление неметаболизированного гликогена в тканях вызывает характерные проявления заболевания — прогрессирующая мышечная слабость (синдром «вялого ребенка», трудности при кормлении, повышенная гибкость тела и неспособность удерживать голову).
Инфантильная форма болезни Помпе проявляется в неонатальном периоде и имеет быстро прогрессирующее течение. Именно при этой форме заболевания развиваются выраженная кардиомегалия и кардиомиопатия. К сожалению, поражения сердца диагностируются в возрасте 4 месяца у 92% малышей. Это нервно-мышечное заболевание можно лечить, но эффективность лечения зависит от сроков начала терапии. Единственным средством патогенетической терапии этого заболевания является препарат Майозайм.
Эндокардиальный фиброэластоз — редкое заболевания сердца у детей, которое начинается в период внутриутробного развития и полностью проявляется у грудных детей. Для этого заболевания характерно утолщение эндокарда (внутренняя оболочка камер сердца) нескольких камер, увеличение сердца и раннее развитие сердечной недостаточности. Первичный фиброэластоз связывают с мутацией определенного гена, а вторичный развивается на фоне обструктивных пороков сердца (чаще левых его отделов). В любом случае — это реакция эндокарда на кардиальный стресс, в результате которого происходит переход нормальных клеток эндокарда в фибробласты, вырабатывающие коллаген и эластин.
Результатом этих процессов является распространенное утолщение эндокарда. При первичном фиброэластозе эндокарда сердце значительно увеличивается в размерах и имеет форму шара. Процесс фиброзирования распространяется на створки клапанов митрального и аортального клапана с нарушением их функции и с повышением риска тромбообразования. При одном варианте течения заболевание проявляется уже в первые часы после рождения острой сердечной недостаточностью, кардиогенным шоком и тромбоэмболиями. Состояние ребенка крайне тяжелое и его не удается спасти (ребенок погибает в течение недели). При втором варианте течения заболевание проявляется к 3-6 месяцу. Перинатальная ультразвуковая диагностика этого заболевания возможна со II триместра.
Многие наследственные или врожденные заболевания можно выявить в период беременности. Так кардиомегалия у плода, выявленная при УЗИ исследовании, свидетельствует о различных пороках сердца или кардиомиопатии, которая имеет различный генез. Патология в виде увеличенного сердца выявляется на втором скрининге (в 16-20 недель). Безусловно, диагностика врожденных пороков сердца у плода — самая трудная задача перинатологии и выявление их на ранних сроках беременности эффективно только в 40%.
Однако, выявить кардиомегалию возможно и в дальнейшем тщательно наблюдать за развитием плода, сделать дообследование и выводы о целесообразности сохранения беременности при патологии, не совместимой с жизнью.
Кардиомегалия является одним из УЗИ признаков сердечной недостаточности плода, она выявляется также на фоне:
- антенатального дистресса (преимущественно дилатационная кардиомегалия);
- внутриутробного кардита (гипертрофическая);
- идиопатической миокардиопатии (дилатационная).
Дилатация только правых отделов сердца возможна за счет венозного застоя при аневризме вены Галена (артериовенозная мальформация вены Галена). Это редкая патология врождённого характера. В третьем триместре беременности проводится пренатальная диагностика аневризмы вены Галена (УЗИ и магнитно-резонансная томография плода). При диагностике оцениваются размеры образования, присутствие кардиомегалии, сердечной недостаточности и гидроцефалии. Это дает возможность прогнозировать родоразрешение и последующее лечения ребенка. Лечение (хирургическое) должно выполняться до появления необратимых кардиологических и неврологических осложнений.
Кроме кардиомиопатии к УЗИ-признакам сердечной недостаточности плода относятся:
- Реверсный кровоток в венозном протоке.
- Пульсация вены пуповины.
- Расширение правых отделов сердца.
- Трикуспидальная и митральная регургитация (возврат крови).
- Водянка.
Для уточнения диагноза проводится эхокардиография плода и допплерэхокардиография. В 40% случаев выявляется кардиомегалия, не сочетающаяся с врожденными пороками сердца.
- Нередко при гемолитической болезни плода и общей водянке выявляется и кардиомегалия. Первые признаки гемолитической болезни выявляются на 18-20-й недели беременности.
- Кардиомегалия регистрируется при инфекционном поражения плода цитомегаловирусом и вирусом краснухи. При внутриутробном краснушном синдроме дополнительно может определяться стеноз легочного ствола и коарктация аорты.
- Дилатационная кардиомегалия развивается на фоне фетальной анемии.
- Гипертрофическая кардиомиопатия и кардиомегалия у плода сопутствуют сахарному диабету у беременной. Хроническая гипергликемия во II-й половине беременности вызывает тяжелую гипоксию и ацидоз у плода. У матерей с инсулинзависимым сахарным диабетом рождаются дети с признаками диабетической макросомии (вес более 4000 г), у 50% таких новорожденных определяется диабетическая кардиомегалия и кардиомиопатия. Данная патология затрудняет адаптацию в раннем неонатальном периоде.
- Гипертрофическая кардиомегалия плода-реципиента развивается при монохориальной двойне. Так называемым фетофетальный трансфузионный синдром обусловлен наличием сосудистых сообщений и шунтированием крови от одного плода к другому. При этом один плод — донор, а другой — реципиент. У первого развивается анемия, задержка развития, и маловодие, а у второго — кардиомегалия, эритремия (повышенное содержание эритроцитов), водянка и многоводие.
При выявленных УЗИ-маркерах хромосомной патологии или пороков развития проводится кордоцентез — метод пренатальной диагностики наследственных заболеваний. Для этого исследования получают кровь из пуповины плода. Оптимальный срок исследования — 16-20 недель (в России проводят на 20-21 неделе).
Некоторые медико-генетические центры проводят неинвазивную пренатальную диагностику хромосомных патологий плода, которая является альтернативой кордоцентезу. Присутствие в крови матери неклеточной фетальной ДНК дает возможность проводить неинвазивные для плода пренатальные исследования.
Существует предположение, что в патогенезе идиопатических кардиомиопатий имеет значение митохондриальная дисфункция. Митохондриальные заболевания возникают в связи с наследственными мутациями в митохондриальной ДНК. Описаны кардиомиопатии при таких митохондриальных заболеваниях как синдром MERRF, MELAS, Барта и Кернса-Сейра. Отличительной особенностью заболеваний, связанных с мутациями в митохондриальной ДНК, является относительно позднее их начало. Эти заболевания передаются по материнской линии.
Синдром Барта является причиной гибели плодов мужского пола (выкидыши или мертворождения). Женщины — носительницы мутантного гена и у них 50% вероятность передать ген сыновьям. Девочки, рожденные от женщин-носительниц, здоровы. Кардиомиопатия (сочетание дилатационной и гипертрофической) — основной признак синдрома Барта и в 70% случаев она развивается уже на первом году жизни. У больных имеется риск желудочковой аритмии и смерти. У части больных консервативное лечение сердечной недостаточности неэффективно, что требует трансплантации сердца в возрасте от одного года до 15 лет.
Синдром Кернса-Сейра проявляется неврологическими расстройствами (судороги, спастичность мышц, мозжечковая атаксия, нейропатия, нейросенсорная тугоухость). Со стороны эндокринной системы отмечается недостаточный рост и сахарный диабет. Со стороны сердца — кардиомиопатия и нарушение проводимости.
Генетическая экспертиза митохондриальной ДНК проводится у женщины для уточнения диагноза, что позволяет снизить риски рождения больного ребенка. Существуют «митохондриальные панели», которые включают исследования генов, ответственных за митохондриальные заболевания. Митохондриальная ДНК есть во всех клетках, поэтому для получения ее подходят: кости, зубы, фрагменты частей тела, кровь, сперма, волосы или ногти.
Диета

Диета при сердечной недостаточности
- Эффективность: лечебный эффект через 20 дней
- Сроки: постоянно
- Стоимость продуктов: 1700-1800 руб. в неделю
При всех кардиомиопатиях, осложненных хронической сердечной недостаточностью должна выполняться диета с ограничением соли (диета при сердечной недостаточности). В целом питание зависит от основного заболевания. При ожирении показано ограничение жиров и углеводов (диета при ожирении), при гиперхолистеринемии — ограничение животных жиров (диета при атеросклерозе сосудов). При наличии у больного диабета, на фоне которого развилась кардиомиопатия, питание должно соответствовать Столу №9 (диета при сахарном диабете), но с ограничением соли.
Профилактика
Первичная профилактика поражений миокарда с неизвестной этиологией не проводится. Для специфических вторичных кардиомиопатий важно лечение основных заболеваний. Пренатальная диагностика (проведение скрининга мутаций генов, эхокардиография плода) позволяет не допустить рождения детей с тяжелой не совместимой с жизнь врожденной патологией сердца.
К общим мероприятиям профилактики обострения и прогрессирования уже имеющихся поражений миокарда относятся:
- Исключение чрезмерных физических нагрузок (занятия спортом), которые вызывают усугубление гипертрофии миокарда и внезапную смерть. В то же время больным показана нагрузка по их возможностям.
- Предупреждение вирусных заболеваний, усугубляющих течение кардиомиопатии.
- Работа в средствах защиты при контакте с вредными факторами на производстве.
- Исключение факторов, способствующих прогрессированию заболевания.
- Выполнение необходимых диетических рекомендаций, основным из которых является ограничение потребления соли.
- Снижение веса при ожирении.
- Отказ от приема алкоголя и курения.
Последствия и осложнения
- Тяжелые формы аритмий.
- Сердечная недостаточность.
- Тромбоэмболии.
- Внезапная сердечная смерть.
Прогноз
Прогноз при рестриктивной КМП зависит от основной причины ее развития, но в целом неблагоприятный — смерть в течение пяти лет наступает 70% больных. Дилатационная КМП имеет тяжелое течение и крайне плохой прогноз — двухлетняя выживаемость ДКМП при семейной форме наблюдается всего у 34%-36% больных. При ДКМП вирусной/иммунной природы — 50%.
Если при алкогольной кардиомиопатии уже развилась сердечная недостаточность и больной не прекращает употреблять алкоголь, прогноз неблагоприятный: смерть от алкогольной кардиомиопатии наступает в 75% случаев в течение 3 лет. Отказ от алкоголя до появления тяжелой сердечной недостаточности может приостановить прогрессирование АКМП или даже вызвать обратное ее развитие.
При гипертрофической форме возможны два варианта, в зависимости от мутаций генов. От этого зависит и средняя продолжительность жизни при гипертрофической кардиомиопатии. При наличии злокачественных мутаций с высокой пенетрантностью гена (частота проявления гена в признаках), степенью гипертрофии, тяжелым течением и осложнениями, высоким риском смерти, продолжительность жизни до 30-35 лет.
При мутациях гена тропонина Т отмечается высока смертность (до 90%) даже при отсутствии гипертрофии миокарда. При доброкачественных мутациях наблюдается низкая пенетрантность гена, невыраженная клиника, не высокий риск смерти, у подавляющего большинства продолжительность жизни больше 60 лет.
Большинство больных умирают внезапно и это часто является первым проявлением болезни (у подростков и молодых людей). Около 40% смертей происходит после физической нагрузки, 60% — в состоянии покоя.
При ишемической КМП отмечается зависимость выживания пациентов от объема жизнеспособного миокарда, который можно увеличить, выполняя операцию аортокоронарного шунтирования. Если рассматривается ишемическая кардиомиопатия — причина смерти: тромбоэмболия и тяжелая сердечная недостаточность. Аортокоронарное шунтирование стало распространенной кардиохирургической операцией. Благодаря восстановлению васкуляризации миокарда у больных устраняются приступы стенокардии, но не улучшается сократительная функция миокарда, и соответственно не устраняется основная причина смерти.
В связи с этим больным выполняется сочетанная операция — реваскуляризация миокарда и реконструкция левого желудочка (внутрижелудочковая пластика заплатой). Именно это позволяет улучшить функцию миокарда, уменьшить размеры и форму левого желудочка. Успешное хирургическое лечение дает возможность обратного ремоделирования миокарда.
Прогноз врожденной кардиомегалии сомнительный, поскольку младенцы погибают в 30% случаев, а выжившие имеют серьезные нарушения сердечной деятельности, но совместимые с жизнью. У детей с дилатационной КМП, заболевших до 2-х лет, выживаемость составляет 89,6% в первые 5 лет, у остальных наблюдается полное выздоровление.
У детей, заболевших в школьном возрасте, выживаемость значительно ниже — в первые 5 лет выживают не более 22%. По статистике средняя продолжительность жизни, если брать сроки от начала заболевания, составляет 19,5 месяцев. Причиной смерти детей чаще всего является сердечная недостаточность, не поддающаяся медикаментозному лечению, на втором месте — тромбоэмболии.
Список источников
- Сабиров Л. Ф. и др. Дилатационная кардиомиопатия // Вестник современной клинической медицины. 2012. Т. 5, № 3. С. 56–63.
- Моисеев В.С., Киякбаев Г.К., Лазарев П.В. Кардиомиопатии и миокардиты — ГЭОТАР-Медиа, 2016.- 532 с.
- Амосова Е.Н. Кардиомиопатии. – К.: Книга плюс, 1999. – 421 с.
- Амосова Е.Н. Течение дилатационной кардиомиопатии // Клин, мед. -1991.- N.3.- С.48.
- Фролова Э. Б., Яушев М. Ф. Современное представление о хронической сердечной недостаточности // Вестник современной клинической медицины. 2013. Т. 6, № 2. С. 87–93.





 Карведилол
Карведилол Верапамил
Верапамил Амиодарон
Амиодарон Дигоксин
Дигоксин Варфарин
Варфарин Нитроглицерин
Нитроглицерин












Последние комментарии
Людмила: Я пью квестран длительное время от хологенной диареи, скажите повышает ли препарат ...
Лилия: Где можно купить ма азь Проспидин
Гость: Напишите кто принимал инвермектин в уколах от паразитов, как рассчитывали дозу?
Мария: Посоветовала коллега, когда дочь болела, что ночью просыпалась и не могла спать из-за ...