Гемохроматоз
Общие сведения
Гемохроматоз (синдром перегрузки железом, бронзовый диабет, HFE-гемохроматоз, гемомеланоз, пигментный цирроз печени, сидерофилия) — болезнь накопления железа, обусловленная повышенным всасыванием его в кишечнике, что способствует массивному накоплению железа в различных тканях (печени, сердца, поджелудочной железы, эндокринных желез, селезёнки, коже) и их повреждению (фиброзу) с последующим развитием недостаточности.
Железо относится к одному из важнейших биохимических компонентов, принимающим участие в метаболическом обмене, но в тоже время он является потенциально токсичным микроэлементом, вызывающим окислительные повреждения нуклеиновых кислот. Соответственно процесс гомеостаза в организме человека железа жестко регулируется, подвергаясь процессу рециркуляции путем захватывания/разрушения состарившихся эритроцитов макрофагами печени/селезенки, то есть осуществляется деградация гемоглобина и, соответственно, освобождение железа, которое связывается с ферритином/трансферрином и утилизируется.
Физиологические потери железа в сутки варьируют в пределах 1-2 мг и восполняются естественным путем (употреблением железосодержащих продуктов и всасыванием эквивалентного количества в желудке). Процесс всасывания железа происходит в двенадцатиперстной кишке/начальных отделах тощей кишки и контролируется белками-регуляторами обмена железа. В то время, как избыточное поступление в кровь железа (переливании крови/парентеральное введении препаратов железа) механизма контроля не имеет.
Термин «гемохроматоз» в настоящее время используется преимущественно в контексте клинико-патологического синдрома, который может быть обусловлен как генетически-детерминированным переизбытком железа в организме, так и другими причинами.
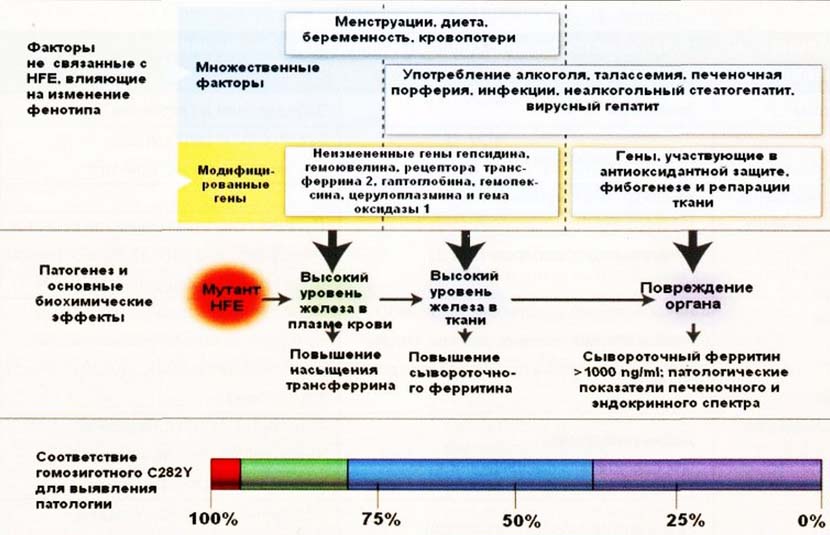
Классический, вызываемый мутацией HFE-гена (C282Y/H63D) представляет собой ступенчатый процесс, начинающийся нарушением процесса насыщения трансферрина, продолжается увеличением сывороточного ферритина и завершающийся конечной стадией — депонированием в жизненно важных органах железа с формированием фиброза/цирроза.
Распространенность наследственного гемохроматоза формы СПЖ варьирует в пределах от 1:1000 до 1:5000 человек. У лиц мужского пола гемохроматоз встречается в 5-7 раз чаще, чем у женщин. При этом у них встречаются чаще тяжелые формы заболевания, протекающие с осложнениями. Манифестирует заболевание преимущественно в возрасте 30-50 лет. Вторичный гемохроматоз встречается у лиц с болезнями печени и гемоглобинопатиями. Гемохроматоз начинает проявляться не сразу, а лишь после того, как переизбыток железа в организме достигает общего содержания железа 20-40 г. Симптомы переизбытка железа в организме манифестируют классическим симптомокомплексом: циррозом печени, пигментацией кожных покровов/слизистых оболочек, сахарным диабетом. Бронзовый диабет сопровождается высокой вероятностью развития гепатоцеллюлярной карциномы (первичного рака печени).
Следует сказать и о накоплении пигмента железа в клетках кожи (болезнь Майокки, болезнь Шамберга, Гужеро-Блюма). Однако, эти заболевания, например, болезнь Шамберга (гемосидероз кожи) имеют совершенно другой патогенез и причины развития. Характерно преимущественно токсико-аллергическое поражения капилляров или наличие эндокринной патологии различного генеза, например, если в организме имеется избыток гормонов щитовидной железы.
Заболевание связано с поражением стенок капилляров кожи, вызывающее увеличение их проницаемости, что способствует превращению железа, вышедшего из гемоглобина сосудистого русла в пигмент гемосидерин, который обуславливает появление специфических коричневого цвета пятен на коже.
Патогенез
Патогенетический механизм врождённого и приобретённого гемохроматоза совершенно различный, также как и патогенез типов в каждой из этих групп. В основе патогенеза врожденного гемохроматоза лежат мутации генов, которые ответственны за синтез белков, принимающих участие в процессе метаболизма железа. Это приводит к разбалансировке процессов поступления и выведения железа, сопровождаемой расстройством насыщения трансферрина, ростом сывороточного ферритина, что приводит к появлению в крови свободного железа.
Патологический процесс завершается накоплением железа в тканях организма и токсическим повреждением органов. Высокая реакционно-токсическая способность ионов железа вызывает оксидативный стресс и инициирует развитие процессов перекисного окисления липидов, что вызывает повреждение клеточных структур (ДНК, мембраны, органелл). Соответственно поражение кардиомиоцитов вызывает токсическую кардиомиопатию; гепатоцитов — фиброз (разрастание коллагена); клеток поджелудочной железы — сахарный диабет; гипофиза — клеток, вырабатывающих гормоны (гонадотропины), регулирующие репродуктивную функцию; клеток эпидермиса — образование пигмента меланина. Наиболее часто поражаемыми органами-мишенями являются печень, поджелудочная железа, сердце, гонады, суставы, гипофиз.
Ниже схематически показана структура патогенеза первичного HFE-ассоциированный гемохроматоза.
Классификация
Различают классический (первичный), генетически обусловленный гемохроматоз и приобретенный (вторичный) гемохроматоз.
Врожденный гемохроматоз в соответствии с типом мутации представлен несколькими типами:
- HFE-ассоциированный наследственный тип гемохроматоза.
- Ювенильный гемохроматоз.
- HFE-неассоциированный наследственный гемохроматоз.
- Гемохроматоз аутосомно-доминантного типа.
- Перегрузка железом организма новорожденных.
Вторичный гемохроматоз представлен несколькими видами:
- Посттрансфузионный гемохроматоз.
- Алиментарный гемохроматоз.
- Метаболический гемохроматоз.
- Гемохроматоз смешанного генеза.
Причины
Причиной наследственного гемохроматоза являются мутации HFE-гена, локализованного в 6 хромосоме на ее на коротком плече. Тип передачи — аутосомно-рецессивный. Мутации вызывают нарушение процесса захвата железа клетками 12-перстной кишки, что приводит к формированию ложного сигнала о недостаточном содержании железа в организме. Это способствует увеличению процесса синтеза энтероцитами железосвязывающего белка и резкому усилению абсорбции железа в кишечнике (на фоне нормального поступлении с пищей). Чрезмерное отложение гемосидерина (железосодержащего пигмента) происходящее в различных внутренних органах, и мягких тканях, вызывает гибель функционально активных элементов с постепенным развитием фиброзно-склеротических процессов.
Причиной развития вторичного гемохроматоза является, как правило, избыточное поступления экзогенного железа в организм (частых гемотрансфузиях, потреблении железа с водой/пищей, неконтролируемом приеме препаратов железа), а также расстройства метаболизма, заболевания крови (талассемии), злокачественные новообразования, низкобелковые диеты, заболевания печени (гепатиты, цирроз).
Симптомы
Симптомы гемохроматоза от начала патологического накопления железа манифестируют не сразу, обычно, клинические признаки появляются через несколько лет. При первичном гемохроматозе клиническая картина более выражен, поскольку переизбыток железа в организме существенно выше. Гемомеланоз развивается в несколько стадий:
- отсутствие перегрузки железом на фоне генетической предрасположенности;
- избыток железа в организме без клинических проявлений;
- стадия манифестации.
Клиническая манифестация приходится преимущественно на зрелый возраст, что обусловлено достижением критических значений содержания в организме общего железа (избыток железа в крови достигает значений 20-40 г). В клинической симптоматике могут преобладать те или иные синдромы, в соответствии с чем выделяют гепатопатическую, кардиопатическую и эндокринологическую формы заболевания.
Для начальной стадии характерны неспецифичные жалобы, проявляющиеся общей слабостью, повышенной утомляемостью, снижением массы тела и либидо. Пациентов могут беспокоить сухость кожных покровов и слизистых, боли в правом подреберье, выраженные артралгии, вызванные хондрокальцинозом крупных суставов. По мере развития формируется классический симптомокомплекс, который манифестирует:
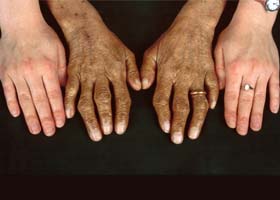
- Пигментацией слизистых оболочек/кожных покровов (бронзовая кожа) преимущественно на шее, лице, подмышками, верхних конечностях и наружных гениталиях. Интенсивность окраски может варьировать от бледно-серого цвета до бронзово-коричневого.
- Циррозом печени, что проявляется увеличением печени и выраженным болевым синдромом в правом подреберье.
- Сахарным диабетом, проявляющимся выраженной жаждой, мышечной слабостью, учащенным мочеотделением.
- Кардиомиопатией с развитием ее осложнений – хронической сердечной недостаточностью, аритмией, инфарктом миокарда, что может сопровождаться потемнением в глазах, головокружением, одышкой при физической нагрузке, отёками ног.
- Артропатией суставов, чаще пястно-фаланговых, реже — тазобедренных, коленных и локтевых с постоянными ноющими болями в суставах и последующим развитием тугоподвижности.
- Гипогонадизмом, проявляющимся у мужчин атрофией яичек, эректильной дисфункцией, выпадением волос на туловище, гинекомастией; симптомы гемохроматоза у женщин дополняются бесплодием, аменореей.
Симптомы переизбытка железа в организме в позднем периоде проявляются кахексией, асцитом, портальной гипертензией, выраженным увеличение печени/селезенки. Летальный исход наступает преимущественно вследствие острой сердечной недостаточности, печеночной недостаточности, диабетической комы, кровотечения из варикозных вен пищевода, асептического перитонита и сепсиса.
Анализы и диагностика
Постановка диагноза осуществляется на основе сбора анамнеза, клинических проявлений и данных лабораторных исследований, в качестве которых используются:
- Общий/биохимический анализ крови.
- Исследование метаболизма железа (процент насыщения трансферрином).
- Биопсия печени.
- Молекулярно-генетическое исследование при подозрении на первичный гемохроматоз (анализ на мутации в гена HFE).
При поражение внутренних органов может назначаться МРТ/КТ печени, УЗИ органов брюшной полости, ЭКГ, рентгенография суставов.
Лечение
Лечение направлено на удаление избытка железа из организма и минимизацию риска развития необратимого поражения органов и тканей.
Кровопускания
Традиционным методом лечения являются кровопускания, которое проводится пожизненно. Начальный курс составляет одну процедуру в неделю в объеме 500 мл. После достижения снижения уровня гемоглобина на 15-20 г/л, а показаний сывороточного ферритина до 20-40 нг/мл вводится этап поддерживающей терапии – кровопусканию по 500 мл крови один раз в 2-4 месяца у лиц мужского пола и каждые 3-6 месяцев для лиц женского пола. Противопоказаниями к кровопусканиям является сердечная недостаточность, анемии, болезни печени.
Хелатирующая терапия. При невозможности поведения кровопусканий назначают хелатирующее лечение, в основе назначение лекарственных средств из группы комплексонов, связывающих избыток железа в сыворотке крови/тканях и выводящие ионы железа из организма с мочой и фекалиями — дефероксамин (Десферал), деферазирокс (Эксиджад).
Однако, с учетом короткого периода полураспада этих препаратов, необходимо медленное их введение: 3-4 часовые инфузии внутривенно или 12/24 часовые инфузии подкожно через специальные помпы. Одновременно назначаются препараты для симптоматической терапии, при необходимости проводится лечение сердечной недостаточности, цирроза печени, гипогонадизма, сахарного диабета.
В основе определения эффективности лечения — динамика клинических /лабораторных данных. Как правило, состояние пациентов после курса кровопусканий начинает улучшаться: уменьшаются размеры печени, купируется симптоматика кардиомиопатии и сахарного диабета, исчезает сонливость, утомляемость, слабость.
Доктора
Лекарства
Детоксицирующее средства (Десферал, Эксиджад).
Процедуры и операции
Кровопускания.
Диета
Несмотря на отсутствие специальной диеты, правильный рацион питания является важнейшей составляющей лечения этого заболевания. Прежде всего, должно быть максимальное ограничение на употребление различных продуктов, содержащих как гемовое, так и негемовое железо (мясо, куриное яйцо, сыр, творог, треска, горбуша, гречневую/пшенную крупы, яблоки, бобовые, клубневые, спаржу хлеб зерновой, сухофрукты, квашенную капусту, кабачки, патиссоны, черную смородину и др). Не рекомендуется употреблять аскорбиновую кислоту, что обусловлено ее способностью усиливать процесс всасывания железа в кишечнике, а также мультивитаминные комплексы, в составе которых присутствует железо. Следует полностью исключить употребление алкогольсодержащих напитков. Ниже приведена таблиц веществ, усиливающих/подавляющих процесс всасывания железа.
| Подавляют всасывание железа | Усиливают всасывание железа |
| Фитины, танины, оксалаты, соли кальция и фосфора, (чай, кофе, шпинат, зерно, кукуруза, рис, коровье молоко, сыр, яйца), дубильные вещества, пищевые волокна, некоторые медикаменты | Аскорбиновая, яблочная, лимонная кислоты, медь, марганец, аминокислоты, животный белок, простые углеводы (сорбит, лактоза, фруктоза), алкоголь |
В развёрнутой стадии заболевания при развитии кардиопатии, цирроза, сахарного диабета назначается соответствующее диетическое питание Диета при сахарном диабете, Диета при циррозе печени и т. д.
Профилактика
Каких-либо методов специфической профилактики первичного гемохроматоза не существует. В качестве общих профилактических мер можно рекомендовать раннее проведение генетического анализа лицам, чьи родственники имеют такую проблему. И в случаях выявления таких мутаций следует проводить регулярное определение показателей метаболизма железа.
Профилактика вторичного гемохроматоза заключается в ограничении избыточного поступления железа в организм с пищей, соблюдению дозировок принимаемых препаратов железа, лечению имеющихся заболеваний печени, а при необходимости — проведение превентивной хелатирующей терапии, например, на фоне длительных гемотрансфузий.
Последствия и осложнения
Гемохроматоз характеризуется высоким риском развития широкого спектра неблагоприятных последствий. К наиболее часто встречаемым относятся поражения печени (печеночная недостаточность), массивные кровотечения в пищеводе из расширенных вен, гепатоцеллюлярная карцинома, гипогонадизм, способствующий развитию бесплодия, сахарный диабет. Реже развивается сердечно-сосудистые осложнения — жизнеугрожающие аритмии, острая сердечная недостаточность, инфаркт миокарда. Лица с гемохроматозом более чувствительны к инфекциям (иерсиниоз и др.).
Прогноз
Прогноз перегрузки железом определяется своевременностью диагностики и длительностью заболевания. При отсутствии лечения продолжительность жизни пациентов с гемохроматозом составляет порядка 4-5 лет, в то время как при своевременно начатом адекватном лечении может составлять 20-30 лет от момента выявления заболевания. Основными причинами, приводящими к гибели пациентов являются токсическая кардиомиопатия, цирроз печени с выраженной печеночной недостаточностью, реже — гепатоцеллюлярная карцинома и декомпенсированный сахарный диабет.
Список источников
- Смирнов О.А. Частота и морфологическая характеристика гемосидероза печени // Российский медицинский журнал. – 2002. – №6. – С.11–13.
- Еремина Е. Ю. Гемохроматоз в практике клинициста // Медицинский альманах – 2015 - №1. С. 75-76.
- Полунина Т.Е., Маев И.В. Синдром перегрузки железом: современное состояние проблемы// Фарматека. — 2008. — № 13. — С. 54–61.
- Клинические рекомендации по диагностике и лечению вторичной перегрузки железом/ под ред. Савченко В. Г. - 2014.
- Кузнецова А.В., Дуботолкина Е.В., Лойфман Е.А. Показатели обмена железа при хроническом гепатите С. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2009. № 19 (5). С. 92.


















Последние комментарии
Людмила: Я пью квестран длительное время от хологенной диареи, скажите повышает ли препарат ...
Лилия: Где можно купить ма азь Проспидин
Гость: Напишите кто принимал инвермектин в уколах от паразитов, как рассчитывали дозу?
Мария: Посоветовала коллега, когда дочь болела, что ночью просыпалась и не могла спать из-за ...