Миелофиброз
Общие сведения
Миелопролиферативное заболевание (МПЗ) – представляет собой группу заболеваний, которая согласно квалификации ВОЗ (2016) включает несколько подкатегорий: первичный миелофиброз, хронический миелолейкоз, хронический эозинофильный лейкоз, истинную полицитемию, хронический нейтрофильный лейкоз, эссенциальную тромбоцитемию и неклассифицированные миелопролиферативные неоплазии.
Заболевание возникает на уровне стволовой кроветворной клетки и обусловлено ее трансформацией. Для него характерен миелопролиферативный синдром. Термин «миелопролиферативный» означает неконтролируемое разрастание одной/нескольких линий миелопоэза, сопровождаемое повышенной продукцией миелоидных клеток (мегакариоцитов, гранулоцитов, тучных эритроидных клеток).
Первичный миелофиброз (синоним — идиопатический миелофиброз) — это заболевания костного мозга, относящееся к группе клональных миелопролиферативных заболеваний для которого характерен фиброз костного мозга, увеличение селезенки и печени и формирование в этих органах экстрамедуллярных очагов кроветворения. Термин «идиопатический» означает заболевание неизвестного происхождение, возникающее самостоятельно. По сути, первичный миелофиброз — это хроническое миелопролиферативное заболевание, представляющее собой генерализованный процесс с изменением гемопоэза и перестройками в различных областях костного мозга фибротического и/или склеротического характера, который сопровождается полным изменением архитектоники кроветворения.
Первичный миелофиброз (ПМФ) протекает в двух стадиях: миелопролиферативной, при которой в костном мозге вырабатываются патологические форменные элементы крови (гиперплазия гемопоэтических клеток костного мозга) и костномозговой недостаточности с явлениями фиброза. Течение заболевания хроническое и в начальной стадии бессимптомное. В литературе это заболевание описывалось и в разные времена называлось как первичный остеомиелофиброз, остеосклероз, агногенная миелоидная метаплазия, фибромиелолейкоз, хронический миелофиброз. Согласно последней классификации миелоидных новообразований (ВОЗ, 2016 г) эти синонимы не употребляются и принято единое название — первичный миелофиброз.
Заболевание встречается редко, показатели заболеваемости ПМФ варьируют в пределах 0,3-1,6
случая/100 000 населения. Гендерных различий нет, наиболее часто заболевание диагностируется в возрасте после 50 лет, медиана 62,5 лет с вариациями от нескольких месяцев до 10-15 лет. Заболевание зачастую осложняется быстро прогрессирующей анемией, симптомами опухолевой интоксикации и спленомегалией. Причинами смерти пациентов чаще всего являются бластная трансформация и прогрессирующие заболевания, осложненные портальной гипертензией, аутоиммунной гемолитической анемией, тромбозами, развитием кровотечений и присоединением инфекции.
Патогенез
Патогенез ПМФ чрезвычайно сложен и до конца не изучен. Развитие заболевания представляет собой цепь патогенетических процессов, основой которых является появление (образование) патологического клона, являющегося главным двигателем заболевания и развившегося воспалительного процесса, протекающего с характерным изменением остова костного мозга и выраженной экспрессией цитокинов.
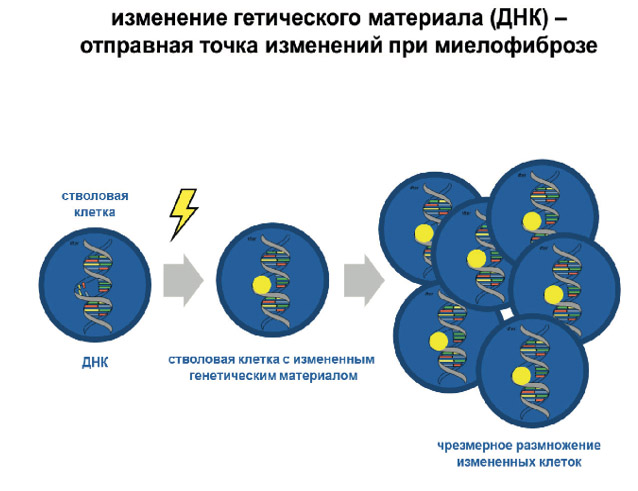
В процессе пролиферации мегакариоциты и лейкемические моноциты активно продуцируют различные виды патологических цитокинов, избыточное содержание которых стимулирует процесс фиброза и приводит к остеосклерозу. При этом, грубо нарушается связь стволовых клеток костного мозга с микроокружением, что при водит к формированию экстрамедуллярных очагов гемопоэза в селезенке и печени. Выброс цитокинов является также ведущей причиной возникновения комплекса симптомов опухолевой интоксикации, приводящей к выраженному ухудшению качества жизни больных.
В патогенез заболевания вовлечен ростовой фактор, продуцируемый тромбоцитами, эндотелиальный (сосудистый) фактор роста и трансформирующий фактор роста бета-миелоидных предшественников. Вероятно, что под влиянием цитокинов, металлопротеиназ и хемокинов формируется межклеточное патологическое взаимодействии мегакариоцитов, нейтрофилов и моноцитов, приводящее к выходу миелоидных предшественников. По сути, в основе миелофиброза лежит неспецифическая воспалительная реакция на образующиеся медиаторы воспаления и цитокины, продуцируемые трансформированным клоном. При этом, значение имеет не только выраженная пролиферация и дефект созревания мегакариоцитарного ростка, но и пролиферация базофилов и тучных клеток, гиперплазия моноцитов-макрофагов.
Классификация
В клинике ПМФ выделяют две фазы, которые отражают степень прогрессирования тяжести заболевания: хроническую фазу и бластную фазу (фазу терминальную бластной трансформации).
- Хроническая форма, по сути, является начальной стадией заболевания, которая диагностируется у более чем 90% впервые выявленных пациентов. Для нее характерны изменения в крови (лейкоэритробластоз, сдвиг кровяных клеток в нейтрофильном/эритроидном ряду вплоть до молодых форм и присутствие промежуточных форм созревания). Клинически проявляется симптомами опухолевой интоксикации, увеличением печени и селезенки.
- Бластная фаза — это терминальная стадия патологического процесса. Определяется по наличию в костном мозге/периферической крови бластных клеток, удельный вес которых при этом превышает 20%.
Стадии ПМФ
По морфологическому (гистологическому) признаку выделяют:
- пре-фиброзную/раннюю стадию, которая характеризуется гиперклеточностью костного мозга, пролиферацией и расширением гранулоцитарного и мегакариоцитарного ростка с атипичным развитием мегакариоцитов, наличием в минимальном объеме/отсутствием ретикулинового фиброза. При этом на этой стадии лейкоэритробластоз, анемия и спленомегалия в подавляющем большинстве случаев отсутствуют.
- Фиброзную стадию. Характеризуется фиброзом (ретикулиновым/коллагеновым) костного мозга или остеосклерозом, редукцией эритроидного ростка, выраженными атипичными элементами мегакариоцитопоэза. Для клинической картины характерны спленомегалия, выраженная анемия, лейкоэритробластоз.
Переход пре-фиброзной стадии в фиброзную в среднем занимает около 4 лет и наблюдается в 65% случаев, трансформация в острый лейкоз варьирует в пределах 5-30% случаев. Однако, процесс прогрессирования в фиброзную стадию может замедляться или вообще отсутствовать в течение 10-15 лет.
Причины развития и факторы, способствующие заболеванию
Этиология ПМФ до настоящего времени точно не установлена. Принято считать, что в основе возникновения заболевания лежит врожденная предрасположенность к болезни. Ее реализация (повреждение генома физиологически нормальной гемопоэтической клетки) происходит под воздействием различных внешних факторов, способствующих ее злокачественной трансформации.
Наиболее вероятной причиной развития болезни являются мутации в генах JAK2 и MPL, что приводит к активации JAK-STAT сигнального пути и усиленной пролиферации миелоидного ростка, однако причина выраженного процесса фиброза костного мозга до настоящего времени остается неясной.
Также развитию первичного миелофиброза способствует нарушение иммунного статуса пациентов (в периферической крови — повышенный уровень иммунных комплексов и IgG, увеличение содержания иммунокомпетентных клеток, моноклональная гаммапатия).
Симптомы заболевания костного мозга
Клиника первичного миелофиброза вариабельна и не имеет патогномоничных симптомов. В подавляющем большинстве случаев заболевание на протяжении ряда лет протекает бессимптомно, а его манифестация проявляется несколькими синдромами. Нередко заболевание обнаруживаются при обращении пациента по поводу другого заболевания и проведения клинического анализа крови, в котором присутствуют специфические изменения картины периферической крови или во время проведения профилактического осмотра при случайном выявлении спленомегалии.
Основными клиническими проявлениями заболевания являются:
- Синдром опухолевой интоксикации. Обусловлен усиленным клеточным катаболизмом. Проявляется снижением аппетита, длительно сохраняющейся и прогрессирующей слабостью, снижением массы тела, болями в костях и суставах, потливостью, познабливанием, субфебрилитетом, кожным зудом и геморрагическими высыпаниями (петехии) на коже, обострениями и утяжелением клиники сопутствующих заболеваний.
- Синдром опухолевой пролиферации. Для него характерны боль в левом подреберье и постоянное чувство тяжести в этой области, обусловленное увеличением селезенки/печени, а также симптомы поражения других органов, в которых развиваются очаги экстрамедуллярного кроветворения (брюшина, лимфатические узлы, легкие, плевра).
- Анемический синдром. Проявляется одышкой, слабостью, тахикардией, снижением толерантности к физической нагрузке, бледностью слизистых/кожных покровов, гипотонией, осложнениями со стороны сердечно-сосудистых заболеваний.
- Геморрагический синдром. Характерна повышенная кровоточивость в виде петехиальных кровоизлияний, появляющихся на фоне незначительных травм (ушибы, сдавления, удары), меноррагии (обильные продолжительные менструации).
- Тромботический синдром. Проявляется тромбозами и тромбофлебитами периферических сосудов, тромбоэмболиями сосудов органов, нарушениями мозгового кровообращения, инфарктом миокарда.
- Синдром инфекционных осложнений. Заболевание сопровождается частыми инфекционными заболеваниями и развитием оппортунистической инфекции.
- Спленомегалия/гепатомегалия. Характерно развитие варикозного расширения вен пищевода, синдрома портальной гипертензии, асцита и периферических отеков, обусловленные компрессией органов.
Тяжесть и выраженность тех или иных симптомов тесно коррелирует со стадийностью патологического процесса. На начальном этапе заболевания происходит быстрое наращивание опухолевой массы и усиленная секреция цитокинов, что вызывает симптоматику опухолевой интоксикации. Выход в периферическую кровь клеток-миелоидных предшественников является причиной возникновения очагов экстрамедуллярного кроветворения в селезенке/печени с развитием спленомегалии и соответствующих симптомов, прежде всего — синдрома портальной гипертензии.
Развившийся тромбоцитоз/лейкоцитоз нарушает микроциркуляции в кровеносных сосудах и способствует развитию тромбозов, что способствует развитию симптоматики сердечно-сосудистых заболеваний. Изменения стромы костного мозга в виде остеомиелофиброза приводят к полному нарушению архитектоники кроветворения и развитию цитопений: анемического синдрома с клиническими проявлениями, лейкопении с развитием инфекционных осложнений, тромбоцитопении с развития спонтанных кровотечений, которые в ряде случаев могут представлять опасность для жизни. Дальнейшая пролиферация опухолевого клона вызывает более высокую степень малигнизации, являющуюся следствием бластной трансформации с развитием терминальной стадии заболевания.
Анализы и диагностика
Диагноз первичного миелофиброза устанавливается на данных комплексного обследования пациента, который включает:
- Жалобы пациента и анамнез.
- Физикальное обследование (оценка окраски слизистых оболочек и кожи), осмотр нижних конечностей на наличие пигментаций, отеков, трофических расстройств, геморрагий, пальпация селезенки/печени, оценку состояния сердца, легких, почек, ЖКТ.
- Лабораторную диагностику (клинический анализ крови с использованием автоматического анализатора для дифференциального подсчета клеток крови; исследование морфологии тромбоцитов, эритроцитов, нейтрофилов); определение СОЭ. Биохимический анализ крови (уровень лактатдегидрогеназы).
- Молекулярно-генетическое исследование крови (ПЦР на наличие мутации гена JAK2, а при ее отсутствии — мутация гена CALR, MPL).
- Инструментальную диагностику (УЗИ органов брюшной полости, фиброгастродуоденоскопию, рентгенографию органов грудной клетки и трубчатых костей, Эхо КГ, ЭКГ).
- Биопсия (трепанобиопсия костного мозга) с цитогенетическим исследованием биоптата костного мозга на выявление ретикулиновых и коллагеновых волокон. Биопсия костного мозга при заболевании крови является наиболее информативным и достоверным методом исследования. При постановке диагноза необходимо учитывать, что практически все клинические признаки первичного миелофиброза неспецифичны и могут быть обусловлены целым рядом заболеваний и патологических состояний, поэтому гистологическое исследование костного мозга относится к важнейшим критериям диагностики заболевания.
Согласно классификации ВОЗ 23016 года диагноз первичный миелофиброз ставится при наличии 3-х больших и 2-х малых диагностических критериев (рис. ниже).

Лечение
Стандарт оказания медицинской помощи при хроническом миелофиброзе дополнен и пересмотрен в 2015 г. Медикаментозное лечение не приводит к полному излечению, но улучшает качество жизни (устранение анемии, тромбоцитопении, спленомегалии, интоксикации), увеличивает общую выживаемость и предупреждает осложнения и прогрессирование заболевания.
Стандарт оказания медицинской помощи включает:
- лекарственные препараты различных групп;
- лучевую терапию;
- хирургическое лечение (удаление селезенки, операции по коррекции портальной гипертензии);
- алло-ТКМ и трансплантация стволовых клеток;
- переливание компонентов крови (гемокомпонентная терапия).
Лечение хронической фазы проводится цитостатическими лекарственными препаратами или интерферонами, как в виде монотерапии, так и сочетанного их применения. В бластной фазе — по программам лечения острых лейкозов с учетом возраста больных. Выбор тех или иных лекарственных средств и, в целом тактики лечения, зависит от группы риска, степени выраженности симптомов и возраста больного.
Лечение пациентов группы низкого риска
Это больные, имеющие нормальные значения гемоглобина, умеренный лейкоцитоз и фиброз костного мозга, у них отсутствует бластемия. При отсутствии симптомов интоксикации часто проводится только динамическое наблюдение, поскольку использование агрессивных методов лечения вызывает риск побочных эффектов.
У пациентов низкого риска, но с минимальными клиническими проявлениями, которым еще не показана специфическая терапия, проводится симптоматическое лечение:
- лечение анемии андрогенами, препаратами железа, витаминами и эритропоэтинами;
- устранение симптомов опухолевой интоксикации — глюкокортикоиды.
Эритропоэз-стимулирующие препараты назначают с целью стимуляции эритропоэза и устранения анемии. Лечение анемической формы заболевания без ретикулоцитоза заключается в применении препаратов рекомбинантного эритропоэтина, который вводится подкожно. Эффект от применения эритропоэтинов сохраняется около года.
Глюкокортикоиды назначаются для быстрого купирования симптомов опухолевой интоксикации. Особенно показано их назначение при гемолитической анемии и тромбоцитопении. Эта группа препаратов снижает секрецию цитокинов, уменьшает разрастание фибробластов и соединительной ткани. Они подавляют катаболизм (распад) белков и стимулируют гибель клеток опухоли. Вместе с тем, имеют побочные реакции, а эффект их применения нестойкий, поэтому нужна поддерживающая терапия (почти постоянная).
Гормональные препараты применяются не только в качестве симптоматической терапии, но и в комбинированной терапии с иммуномодуляторами. При использовании глюкокортикостероидов необходимо учитывать противопоказания (остеопороз, сахарный диабет) и побочные эффекты (усугубление остепороза, развитие синдрома Иценко Кушинга).
Андрогены (анаболические стероиды) показаны при анемической форме заболевания. Их механизм действия близок к кортикостероидам и основное действие — уменьшение опухолевой интоксикации, угнетение катаболизма, стимуляция гемопоэза. У 30–40 % больных после их применения отмечается повышение уровня гемоглобина. Вводятся внутримышечно раз в неделю. Эффективность оценивается через 6 месяцев. Побочные эффекты: задержка жидкости, гирсутизм, токсическое действие на печень и повышение риска опухолей печени. Противопоказаны при раке простаты в анамнезе.
В случае, если быстро увеличиваются размеры селезенки и появляется угроза ее разрыва, не устраняются слабость, потливость, что говорит о неэффективности симптоматической терапии, больным показано применение цитостатиков, ингибиторов jak2 (Руксолитиниб), а также препаратов интерферона.
Лечение пациентов группы промежуточного-2 и высокого риска
У этих больных отмечается выраженная анемия, высокий лейкоцитоз и сдвиг до бластов, тромбоцитопения, выраженный фиброз костного мозга. Возможно быстрое развитие бластной трансформации.
В данном случае назначаются основные группы препаратов:
- цитостатики, которые сдерживают разрастание опухоли и улучшают показатели крови;
- препараты интерферона альфа;
- ингибиторы jak2 (ингибиторы янускиаз);
- глюкортикоиды (при наличии интоксикации);
- иммуномодуляторы;
- эритропоэтины.
Выбор той или иной группы препаратов, а также назначение их в различных комбинациях зависит от возраста больного и клинической картины. У лиц до 45 лет, не имеющих сопутствующей патологии, сразу обсуждается возможность проведения трансплантации. При невозможности ее выполнения предлагается медикаментозное лечение. Показанием к цитостатической терапии служит нарастающий лейкоцитоз, тромбоцитоз и увеличение селезенки. Помимо цитостатиков у молодых пациентов целесообразно применение препаратов интерферона.
В возрасте 45-65 лет чаще всего используется стандартная лекарственная терапия. При отсутствии противопоказаний редко, но выполняется алло-ТКМ. У больных старше 65 лет важно поддерживать качество жизни и купировать осложнения заболевания. В этом возрасте проводится лечение ингибиторами jak2 (ингибиторы янускиназ), руксолитинибом (Джакави).
Характеристика основных лекарственных групп, применяемых для лечения.
- Цитостатики сдерживают пролиферацию опухоли и предупреждают развитие всевозможных осложнений заболевания. Они назначаются длительно по схеме, с переходом на поддерживающую дозу и последующим перерывом. Возобновление нового курса делают при повышении тромбоцитов (200×109/л и лейкоцитов 5×109 л). Лечебный эффект препарата Гидреа проявляется только при его приеме, а отмена влечет возобновление симптоматики. Поэтому препарат необходимо принимать регулярно и постоянно (у некоторых больных — без перерыва). В первые два месяца назначения препарата еженедельно контролируется количество лейкоцитов и тромбоцитов, поскольку для цитостатических препаратов характерно развитие цитопенических состояний.
- В стадии миелопролиферации (повышенное количество лейкоцитов, тромбоцитов) также эффективен Милеран, Миелосан, Мелфала. Однако эти препараты используются очень осторожно и в минимальных дозах, поскольку быстро вызывают глубокую панцитопению (снижение уровня всех клеточных элементов крови), которая очень трудно восстанавливается. При высоком уровне лейкоцитов и тромбоцитов эти препараты назначаются вместе с преднизолоном. Милеран хорошо переносится и после первого курса ремиссия продолжается 12–15 месяцев. Поддерживающее лечение способствует удлинению ремиссий.
- Ингибиторы янускиназ блокируют активность JAK2-киназ и действует на ключевое звено патогенеза заболевания (прицельный механизм действия). Киназы передают сигналы от цитокинов и факторов роста, имеющих роль в гемопоэзе и состоянии иммунной системы организма. В исследованиях показана эффективность этих препаратов в отношении уменьшения клона опухолевых клеток. У большинства больных нормализуется уровень лейкоцитов и тромбоцитов, уменьшается селезенка и симптомы интоксикации, повышается переносимость физических нагрузок. В целом, у больных улучшаются показатели качества жизни и значимо улучается общая выживаемость. Наиболее частые побочные эффекты: анемия, уменьшение количества тромбоцитов и синдром «цитокиновой отдачи» (возврат симптомов интоксикации, воспалительной реакции и увеличения селезенки).
Для пациентов промежуточного-2 и высокого риска препараты ингибиторов янускиназ являются препаратами выбора, а для больных промежуточного-1 риска они рекомендуются в случае нечувствительности к другим цитостатикам. Данные препараты являются основными для пациентов, которым необходимо быстро уменьшить размеры селезенки и устранить симптомы интоксикации перед операцией по пересадке костного мозга.
- Лечение препаратами интерферона целесообразно у молодых больных и эффективно при хронической фазе болезни, а бластной фазе эффективность не доказана. Препараты эффективны при повышении тромбоцитов и эритроцитов в крови, меньший эффект получен при лейкоцитозе. В ряде случаев этими препаратами возможно приостановить развитие заболевания и в небольшом проценте случаев получить обратное развитие миелофиброза. Терапия проводится в максимально переносимых дозах, которыми достигается хороший контроль показателей крови. Инъекции проводят 6 раз в неделю (дозировка 3–5 млн МЕ) до достижения ремиссии, далее при нормализации показателей крови, уменьшении размеров селезенки (это занимает 4-6 месяца) пациента переводят на поддерживающее лечение с инъекциями 2-3 раза в неделю. Лечение проводится не менее года, а при хорошей переносимости его продляют на 2-3 года. Сочетанное применение цитостатиков и интерферонов повышает эффективность терапии и при этом после достижения улучшения можно уменьшать дозы каждого препарата.
- Иммуномодуляторы и препараты, ингибирующие ангиогенез, к которым относят Талидомид и Леналидомид, используют отдельно или в сочетании с преднизолоном. Талидомид + Преднизолон назначают 3 месяца. Преднизолон принимают по схеме с уменьшением дозы каждый месяц, а Талидомид в одной дозе (50 мг) ежедневно.
Лечение и профилактика осложнений основного заболевания:
- Сочетание цитостатической терапии с назначением аллопуринола с целью профилактики мочекислого диатеза, поскольку лизис опухоли связан с повышением уровня мочевой кислоты в крови. Больному также рекомендуется повышенное употребление жидкости.
- Профилактика и лечение тромбозов. Высокий уровень тромбоцитов в сочетании с лейкоцитозом, особенно у лиц пожилого возраста, сопровождается риском тромбозов. Риск образования тромбов вызывает также лечение иммуномодуляторами. Для профилактики этого осложнения применяется ацетилсалициловая кислота, а при значительном тромбоцитозе назначается Гидреа. Лечение случившегося тромбоза проводится антикоагулянтами (прямого и непрямого действия).
- В случае выраженной лейкопении в сочетании с анемией применяют эритропоэтин в сочетании с колониестимулирующими факторами (Г-КСФ и ГМ-КСФ), которые увеличивают количество нейтрофилов крови.
- Проведение профилактики вторичного гемосидероза (препарат Деферазирокса). Уменьшение гемосидероза костного мозга улучшает гемопоэз.
- Присоединение бактериальной, вирусной или грибковой инфекции требует соответствующего лечения.
- Для коррекции водного и электролитного баланса больному показаны инфузионные растворы.
- Парентерального питание — комплекс аминокислот, эмульсия для инфузий, содержащая смесь оливкового и соевого масел в соотношении, раствор аминокислот с электролитами, гидроксиэтилкрахмал, раствор декстрозы.
- Лицам пожилого возраста с сердечно-сосудистыми заболеваниями, артериальной гипертензией назначается соответствующее лечение.
- При выраженной боли в костях показан опиоидный анальгетик фентанил.
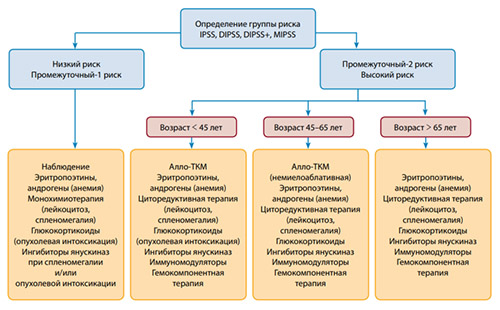
Алгоритм лечения больных
Доктора
Лекарства
- Цитостатические препараты: Гидроксиуреа, Гидреа, Гидроксикарбамид медак, Милеран, Циклофосфан, Цитозар, Меркаптопурин, Пури-Нетол, Цитарабин, Алексан, Цитостадин.
- Интерфероны: Альтевир, Реальдирон, Альфарона, Интрон А, Интерфераль, Роферон-А, Реаферон-ЕС.
- Глюкокортикостероиды: Преднизолон, Преднизолон Никомед, Метипред, Солу-Медрол, Дексаметазон, Дексамед.
- Анаболические стероиды: Феноболин, Неробол.
- Стимуляторы эритропоэза: Эритростим, Эпрекс, Аранесп, Рекормон и препараты пролонгированного действия.
- Противогрибковые средства: Амфотерицин В, Анидулафунгин, Вориконазол, Итраконазол, Каспофунгин, Микафунгин, Флуконазол, Клотримазол (крем для наружного использования).
- Антибактериальные препараты: Азитромицин, Аугментин, Эритромицин, Моксифлоксацин, Офлоксацин, Ципрофлоксацин, Левофлоксацин, Метронидазол (гель стоматологический). При пневмоцистной пневмонии — Ко-тримоксазол, Ориприм.
- Противовирусные средства: Ацикловир, Валацикловир, Валганцикловир, Фамцикловир, Ганцикловир.
- Влияющие на свертывающую систему: Гепарин, Аминокапроновая кислота раствор, Надропарин, Эноксапарин.
- Растворы при нарушениях электролитного баланса: Натрия хлорид 0,9%, Натрия гидрокарбонат, Кальция глюконат, Калия хлорид, Магния сульфат, Глюкоза раствор.
- Мочегонные препараты: Спиронолактон, Торасемид.
Процедуры и операции
К распространенным процедурам при этом заболевании относятся:
- Лучевая терапия области печени и селезенки.
- Гемотрансфузии компонентов крови (при анемическом и тромбоцитопеническом варианте заболевания).
- Гемоэксфузии (кровопускания при эритремическом варианте заболевания).
Лечебный эффект лучевой терапии полностью не устраняет симптомы заболевания, а только может их незначительно уменьшить. Регрессу поддаются только размеры селезенки. Лечение имеет кратковременный эффект (от 3 до 6 месяцев), кроме того, сопряжено с риском тяжелых цитопений, которые у 10-15 % становятся причиной летального исхода. Этот вид лечения проводится при:
- увеличении селезенки, но наличии противопоказаний к ее удалению или отказе пациента;
- очагах экстрамедуллярного кроветворения в селезенке и печени;
- сдавливании спинного мозга увеличенными органами;
- выраженных болях в костях.
Лечение предполагает 5-10 сеансов с использованием малых доз облучения на нижнюю треть селезенки. При уменьшении ее размера облучение сразу прекращают. Этот вид лечения приводит к появлению фиброза и спаек селезенки с брюшиной и другими органами. Впоследствии наличие спаек делает удаление селезенки технически сложной.
Трансфузионая поддержка включает переливание эритроцитарной массы при анемии. Снижение гемоглобина до 70г/л является показанием к переливанию эритроцитарной массы, которая на 70-80% состоит из эритроцитов. Процедура может вызывать перегрузку тканей и органов железом (посттрансфузионный гемосидероз) и заражение гемотрансмиссивными инфекциями.
Переливание тромбоцитного концентрата показано при:
- тромбоцитопении (ниже 10х10 9/л) и риске кровотечений, угрожающих жизни больного;
- фебрильной лихорадке, инфекциях, геморрагическом синдроме;
- вторичной коагулопатии, связанной с нарушением функции печени (нужно поддерживать тромбоциты на уровне 20х10 9/л и больше);
- ДВС-синдроме или кровотечении (достигается уровень тромбоцитов больше 50х10 9/л).
Гемоэкфузии (кровопускания) проводятся при признаках нарушения микроциркуляции (недостаточность кровообращения конечностей, снижение зрения, энцефалопатия). При этой процедуре удаляется избыток эритроцитов с целью поддержания гематокрита в пределах 45%. Противопоказанием для проведения процедуры являются тромботические осложнения, которые раньше отмечались у больного. В этих случаях проводится аппаратный эритроцитоферез.
Из оперативных методов применяются:
- Удаление селезенки.
- Хирургическое лечение портальной гипертензии.
- Алло-трансплантации различных видов (костного мозга и стволовых клеток).
Удаление селезенки и в настоящее время имеет свое место у ряда больных, особенно при анемическом и тромбоцитопеническом синдромах. Проводится она в случаях, когда нет других методов лечения, имеет строгие показания:
- синдром сдавления соседних органов;
- невозможность применения препаратов, сокращающих селезенку или их неэффективность;
- гемолитическая анемия, не поддающаяся лечению иммунодепрессивными препаратами;
- нарастающая кахексия;
- тяжелая тромбоцитопения с кровотечениями, не поддающаяся лечению глюкокортикоидами.
При этом учитываются и противопоказания:
- бластная трансформация;
- прогрессирование процесса с анемическим синдромом и выраженным фиброзом;
- тяжелые сопутствующие заболевания в стадии декомпенсации.
Больные после операции имеют лучшую выживаемость, чем те, которым удаление селезенки проводилось без показаний. При всем этом имеется высокий риск операционных осложнений и осложнений после операции.
Длительное увеличение печени и селезенки часто приводит к портальной гипертензии с варикозным расширением вен желудка и пищевода, осложняющимся кровотечениями. Для профилактики этого опасного для жизни осложнения выполняются хирургические операции по наложению анастомозов, которые снижают давление в системе портальной вены.
Алло-трансплантация костного мозга или алло-трансплантация гемопоэтических стволовых клеток — единственный метод лечения в настоящее время, позволяющий добиться полного излечения больных. Может применяться у ограниченного числа пациентов с учетом индивидуальных показаний и не проводится по экстренным показаниям. Обязательно учитываются неблагоприятные факторы операции: пожилой возраст, частично совместимый донор, выраженное увеличение селезенки, продвинутая стадия заболевания.
Этот метод лечения оправдан для больных молодого возраста промежуточного и высокого риска при длительности болезни 1-2 года, учитывая, что длительность жизни таких больных 3 года и один год и 4 месяца соответственно. Тем не менее, трансплантация имеет ограниченное применение в связи с летальностью и проблемами приживления трансплантата.
Диета при миелофиброзе

Диета при онкологических заболеваниях
- Эффективность: нет данных
- Сроки: до выздоровления / пожизненно
- Стоимость продуктов: 2500-4800 руб. в неделю

Диета 15 стол
- Эффективность: лечебный эффект через 2 недели
- Сроки: постоянно
- Стоимость продуктов: 1600-1800 рублей в неделю
При удовлетворительном состоянии больного питание его мало отличается от обычного и может быть рекомендована Диета 15 стол. Дополнительно можно принимать добавки к пище, содержащие недостающие и незаменимые компоненты. При прогрессировании заболевания за основу можно взять диету при онкологических заболеваниях и попытаться увеличить рацион пероральной нутритивной поддержкой.
В стадии бластной трансформации и выраженной кахексии больному может понадобиться специальное искусственное парентеральное питание: смеси необходимых аминокислот с эмульсией оливкового и соевого масел, гидроксиэтилкрахмал, раствор аминокислот с электролитами, комбинированные трехкомпонентные препараты (аминокислоты+глюкоза+жировая эмульсия), раствор декстрозы.
Для энтерального питания используют специализированные смеси для онкологических больных. Лечебное питание содержит легкоусвояемые вещества, полноценный комплекс микро-и макронутриентов. Энтеральное и парентеральное питание можно назначать одновременно при недостаточной эффективности одного. Тем не менее, отмечается, что искусственное питание заметно не влияет на выживаемость.
Профилактика
Меры профилактики не разработаны.
Последствия и осложнения
Остеомиелофиброз имеет следующие осложнения:
- инфекционные, вызванные лейкопенией (экссудативный плеврит, пневмония, тяжелый сепсис, септический шок);
- синдром Свита — септический процесс, сопровождающийся дерматозом, лейкоцитозом и артралгией;
- опухолевая интоксикация;
- тромбозы и тромбоэмболии органов и тканей;
- анемия;
- бластная трансформация;
- патология почек (пиелонефрит, нефросклероз), что связано с повышением уровня мочевой кислоты у этих больных;
- вторичная подагра;
- тромбоцитопения с развитием спонтанных кровотечений;
- цирроз печени с портальной гипертензией и кровотечение из расширенных вен пищевода;
- увеличение селезенки;
- вторичный гемосидероз;
- артериальная гипертензия, нарушения ритма сердца, хроническая сердечная недостаточность;
- очаги внекостномозгового кроветворения;
- острое нарушение мозгового кровообращения;
- нарушения зрения;
- депрессия;
- анорексия.
Инфекционные процессы связаны со вторичным иммунодефицитом и протекают у больных атипично и молниеносно. Помимо бактериальных инфекций, возможны вирусные и грибковые осложнения. После выявления возбудителя с определением его чувствительности к антибактериальным препаратам, проводится рациональное лечение.
Симптомы опухолевой интоксикации (температура, потливость, потеря веса) ухудшают качество жизни больного и ограничивают его жизнедеятельность. Лечение гидроксимочевиной несколько уменьшает выраженность опухолевой интоксикации, а применение глюкокортикоидов и иммуномодуляторов в значительно улучшают состояние больных.
Тромбозы усиливают тяжесть имеющихся сердечно-сосудистых заболеваний. Профилактикой этого осложнения является прием ацетилсалициловой кислоты (должны принимать все больные). При случившемся тромбозе проводится антикоагулянтная терапия.
Анемия часто наблюдается при дебюте заболевания. Для ее коррекции прибегают к переливаниям эритроцитов. Если при анемии выявляется и снижение уровня сывороточного железа, назначаются Сорбифер-дурулес, Тардиферон, Мальтофер, Ферлатум, Феррум-лек и другие. При дефиците витамина В12 внутримышечно вводится Цианкобаламин. Специфическая стимуляция эритропоэза проводится эритропоэзстимулирующими препаратами. Воздействие на иммунологические механизмы анемии осуществляется глюкокортикоидами, андрогенами и иммуномодуляторами, которые в комплексе дают хорошие результаты. Некоторое повышение гемоглобина наблюдается после удаления селезенки.
Бластная трансформация является результатом дополнительных мутаций при долгой пролиферации клона опухолевых клеток. Это приводит к развитию терминальной стадии. Средств профилактики этого состояния не разработано. У молодых больных предпринимается проведение химиотерапии по схемам, разработанным для острых лейкозов — эффект временный и не у всех. Средством лечения, увеличивающим выживаемость, стали ингибиторы янускиназ, эффективность которых превосходит эффективность традиционной терапии. Пожилым проводится сдерживающая монохимиотерапия малыми дозами глюкокортикоидов.
Разрушение клеток опухолевой массы приводит к повышению азотистых оснований. В процессе распада пуриновых нуклеотидов образуется мочевая кислота. Развивается вторичная гиперурикемия с симптомами, схожими с подагрой (суставной синдром, мочекаменная болезнь). Для профилактики назначается аллопуринол и рекомендуется употребление гидрокарбонатных минеральных вод. У больных постоянно контролируется уровень мочевой кислоты в крови.
Тромбоцитопения развивается при выраженном фиброзе костного мозга, когда истощается гемопоэз. Проявление тромбоцитопении — спонтанная кровоточивость. Профилактика кровотечений заключается в укреплении сосудистой стенки (витамин С, рутин, этамзилат), местном лечении геморроидальных узлов, уменьшение портальной гипертензии (бета-блокаторы, блокаторов медленного входа кальция).
Увеличение размеров селезенки представляет значительную проблему. У больных увеличивается и вздувается живот, появляются боли и быстрое насыщение небольшим количеством пищи, сдавливаются другие органы и развивается инфаркт селезенки. К уменьшению ее размеров может приводить Гидроксимочевина. Также с этой целью применяют Бусульфан, Мельфалан, Талидомид и Кладрибин. Если лекарственная терапия плохо переносится или является неэффективной, проводится спленэктомия. После операции у больных исчезают дискомфорт в брюшной полости и отмечается повышение гемоглобина и уровня тромбоцитов.
Скорость развития гемосидероза выше на фоне хронической анемии, поскольку усиливается всасывание железа из ЖКТ. Профилактическое назначение хелаторов железа (Деферазирокс) и контроль ферритина проводят через несколько гемотрансфузий, не дожидаясь развития вторичного гемосидероза.
При длительном течении болезни заболевания внекостномозговое кроветворение развивается не только селезенке и печени, но и в брюшине (развивается асцит), легких (экссудативный плеврит), лимфоузлах (сдавление органов и сосудов). В пораженных органах изменяется структура, сосудистый кровоток и нарушается функция. Для профилактики и лечения таких осложнений применяются иммуномодуляторы с глюкокортикоидами или ингибиторы янускиназ. Также назначают местную низко дозную лучевую терапию.
Прогноз при хроническом миелопролиферативном заболевании
Это заболевание тяжелое со средней продолжительностью жизни 5-7 лет с начала установления диагноза. В то же время продолжительность жизни может составить несколько месяцев — десятки лет. Адекватная диагностика и лечение — главное условие правильного прогнозирования течения заболевания.
Больные низкой группы риска имеют благоприятный прогноз и вероятность выживаемости — 7-15 лет, поскольку у них низкий риск трансформации заболевания в бластную фазу. Сроки от начала заболевания до бластной трансформации очень различаются у разных больных и составляют от 2 лет до десятка лет. При развитии бластной формы, прогноз неблагоприятный — выживаемость составляет несколько месяцев. Причинами смерти становятся бластная трансформация, тяжелая цитопения, тромбозы, кровотечения из вен пищевода, инфекции и сепсис.
Результаты выживаемости после алло-ТГСК зависят от стадии заболевания и группы риска. В группе низкого риска пятилетняя выживаемость после пересадки составляет 76% и, соответственно, уменьшается число больных до 48% и 38% в группе промежуточного-1 и промежуточного-2/высокого риска.
Список источников
- Клиническая онкогематология. Под ред. М.А. Волковой. М.: Медицина, 2001. С. 290–300. Руководство по химиотерапии опухолевых заболеваний. Под ред. Н.И. Переводчиковой. М.: Практическая медицина, 2011. С. 318–321.
- Л.М. Мещерякова, О.В. Пороткова, Л.Г. Ковалева, Л.Ю. Колосова, С.Н. Бычкова. Первичный миелофиброз. //Онкогематология 4. 2011. С. 50-57.
- Абдулкадыров К.М., Шуваев В.А., Мартынкевич И.С. Первичный миелофиброз: собственный опыт и новое в диагностике и лечении //Онкогематология 2. 2015.Том 10. С. 26-36.
- Абдулкадыров, К. М. Клиническая гематология: справочник / К. М. Абдулкадыров. — СПб: Питер Принт, 2006. — 748 с.
- Ковалева Л.Г., Мещерякова Л.М., Колосова Л.Ю., Вахрушева М.В. Хронические миелопролиферативные заболевания: клинико-терапевтические особенности и перспективы. Тезисы Российской научно-практической конференции «Актуальные вопросы гематологии и трансфузиологии», Санкт-Петербург, 8–10 июня 2004 г. С. 36–37.





 Гидреа
Гидреа Альтевир
Альтевир Талидомид
Талидомид Преднизолон
Преднизолон Гепарин
Гепарин Флуконазол
Флуконазол Аугментин
Аугментин Левофлоксацин
Левофлоксацин Ацикловир
Ацикловир













Последние комментарии
Мирослава С.: Мне поставили диагноз метаболического остеоартрита коленных суставов ещё пару лет назад ...
Алексей А.: Диабет осложнил мои проблемы с суставами. Ноги постоянно болели. Попробовал Флексотрон ...
Марина: Статья поразительно безтолковая. Много противоречий. И, прежде всего, боль - в любом ...
Маша: Работаю сутки через трое. После ночной смены обычно отлёживаюсь весь день, потом ничего ...