Рак крови
Общие сведения
Рак крови называется лейкозом. Это не совсем верное определение, поскольку термин «рак» относятся лишь к новообразованиям из эпителия, однако в обиходе равноценно используются понятия «раковый»/«онкологический» под которыми зачастую подразумеваются все остальные злокачественные опухоли.
Лейкозы представлены обширной группой гетерогенных заболеваний системы крови опухолевого генеза, возникающие вследствие мутаций в генах, которые протекают с нарушениями процессов пролиферации, дифференцировки и созревания кроветворных клеток. Такие процессы приводят к «вытеснению» физиологически нормальных кроветворных клеток лейкозными, образованию очагов экстрамедуллярного кроветворения/бластных инфильтратов, негативно воздействующие на структуры/функции организма опухоленосителя.
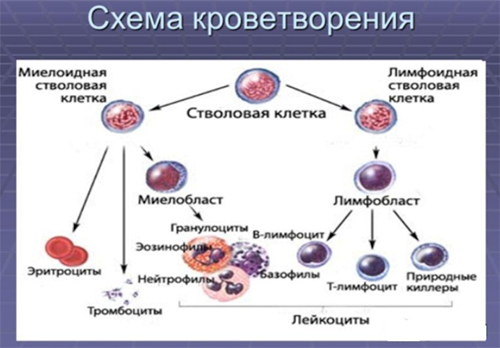
При нормальном костномозговом кроветворении стволовые клетки (бласты, клетки-предшественницы) проходя этапы дифференцировки, созревания в зрелые клетки и размножения, формируют два ростка крови:
- лимфоидный (В-/Т-лимфоциты);
- миелоидный (нейтрофилы — эритроциты, гранулоциты, тромбоциты).
При нарушении созревания бластов в зрелые клетки в костном мозге постепенно накапливаются бласты, при этом, в периферической крови уменьшается количество физиологически нормальных клеток крови и появляются бластные клетки, которые могут формировать внекостномозговые очаги поражения (лимфоузлы, селезенка) при выходе за пределы костного мозга. Лейкозные клетки не тождественны элементам нормального гемопоэза (бластным, созревающим и зрелым клеткам). Для них характерны гистохимические, иммунофенотипические, цитоморфологические и генетические аномалии.
По происхождению (гистогенезу) выделяют формы острого и хронического лейкоза. Следует отметить, что к этим понятиям традиционный подход применять нельзя: острый лейкоз никогда в хронический не переходит, а хронический лейкоз острым стать не может, поскольку при остром лейкозе поражается стволовые (незрелые) клетки крови, а при хроническом — различные созревающие/зрелые клетки крови.
Выделяют две принципиально различающиеся большие группы острых лейкозов:
- острые лимфобластные лейкозы (ОЛЛ);
- острые миелоидные лейкозы (ОМЛ).
Каждая группа делится на множество подвидов, имеющие свои характерные генетические, морфологические, иммунологическими свойства и специфику лечения.
Заболеваемость острыми лейкозами в разных странах варьирует в пределах 2-5 случаев/100 000 населения/в год. При этом, 75-80% всех острых лейкозов у взрослых приходится на ОМЛ и лишь 20-25% на долю ОЛЛ. Средний возраст постановки диагноза ОМЛ — 63 года. При этом, гендерные отличия у лиц молодого/среднего возраста не выявлены, а у старшей возрастной группы преобладают лица мужского пола (3:2).
Максимум заболеваемости ОЛЛ приходится на детский возраст 2-5 лет (средний возраст постановки диагноза 14 лет). Относится к наиболее частым онкозаболеваниям детского возраста. В целом 60% заболевших составляют лица моложе 14 лет, и лишь 24% — старше 45 лет. Гендерные различия отсутствуют.
Острые лейкозы относятся к потенциально излечимым заболеваниям. При ранней диагностике и современной терапии конкретного варианта лейкоза у 65-75% пациентов с ОМЛ и у 75-90% пациентов с ОЛЛ удается добиться полной ремиссии в периоде 5 лет.
В связи с ограниченностью объема статьи рассмотрим лишь острые миелоидные лейкозы у взрослых и острые лимфобластные лейкозы у детей, как наиболее часто встречаемые.
Патогенез
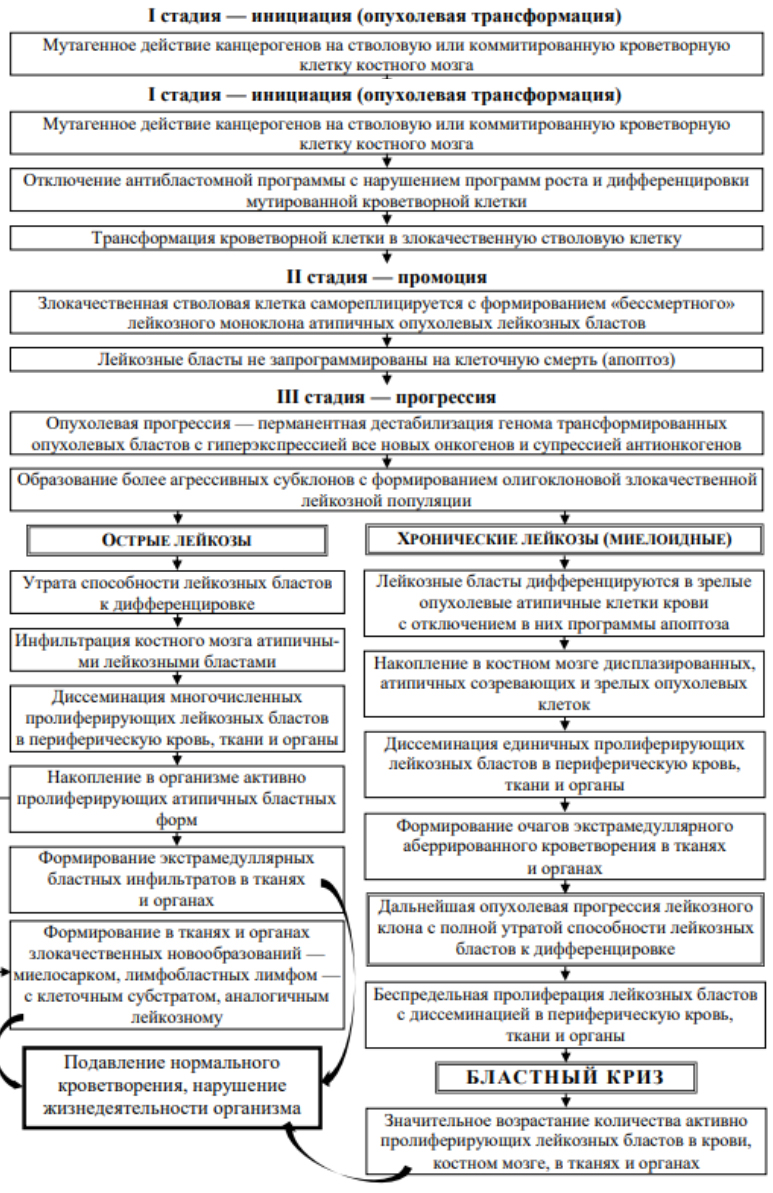
В основе лейкозогенеза лежат молекулярногенетические механизмы. Для патогенеза лейкозов характерны стадийные молекулярно-генетические нарушения, отражающие типичную фазность процесса развития злокачественных новообразований. Выделяют несколько стадий патогенеза:
- Стадия инициации (опухолевая трансформация), развивается в стволовой/коммитированной гемопоэтической клетке костного мозга под влиянием различных канцерогенов. В ее основе точковые делеции (мутации) генов-супрессоров (антионкогенов)/онкогенов с подавлением антибластомной программы, гиперэкспрессия онкогенов. В результате таких генных мутаций мутированная стволовая клетка приобретает способность к беспредельному делению, т. е. опухолевому росту, а гемопоэтическая стволовая клетка теперь становится стволовой лейкозной клеткой.
- Стадия промоции (соответствует моноклоновой стадии лейкоза). В случаях наличия в организме человека промоторных факторов, которые усиливают клеточную пролиферацию, стволовая лейкозная клетка начинает беспредельно делиться, что является основой образования бессмертного моноклона лейкозных клеток с наращиванием в последствии его численности. То есть, в основе формирования опухолевой популяции в костном мозге лежит возникновение вначале одной злокачественной стволовой клетки и затем — образования клона.
- Стадия прогрессии (соответствует олиго-поликлоновой стадии лейкоза). На этой стадии дальнейшие множественные мутации способствуют более выраженной дестабилизации генома измененных клеток моноклона с гиперэкспрессией новых онкогенов на фоне супрессии антионкогенов. Как следствие, возникновение агрессивных злокачественных субклонов с постепенным замещением физиологически нормального гемопоэза, диссеминацией (распространением) опухоленосителя гематогенным путем в различные ткани организма с формированием инфильтратов пролиферирующих бластов, а также очагов извращенного гемопоэза. Таким образом, популяция лейкозных клеток становится олиго-/поликлоновой, оказывающей агрессивное действие, что выражается прогрессирующим клиническим утяжелением течения острых лейкозов или же бластными кризами при хронических лейкозах. Схематически патогенез лейкозов приведен на рисунке ниже.
Классификация
В основе классификации лейкозов лежат различные признаки, согласно которым выделяется несколько видов.
По течению (по способностью клеток крови к дифференцировке и опухолевой прогрессии) острые и хронические.
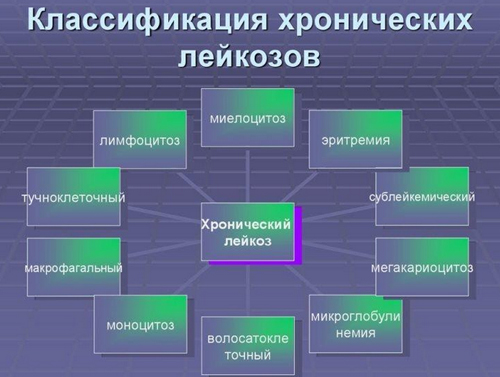
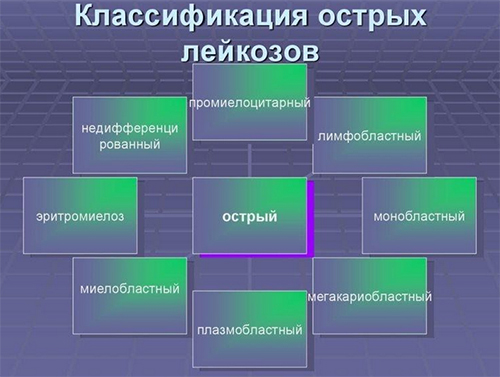
По гистогенезу (ростку гемопоэза):
- Острые лейкозы — недифференцированный, лимфобластный (из В-клеток/Т-клеток предшественников) миелобластный, монобластный, миеломонобластный, мегакариобластный, промиелоцитарный, эритромиелобластный.
- Хронические лейкозы — хронический лимфолейкоз, хронический миелоидный лейкоз, парапротеинемические лейкозы и др.
По общему количеству лейкоцитов — лейкопенические (<4000/мкл); алейкемические (4000–20000/мкл); сублейкемические (20000–50000/мкл) и лейкемические (>50000/мкл).
Причины
Лейкозы являются полиэтиологичными заболеваниями. Установлено, что причиной рака крови являются мутации, являющиеся доказанным предиктором развития заболевания. От чего бывают мутации? Точные причины, запускающие процесс мутации неизвестны, но достоверно установлено, что существуют факторы риска, воздействие которых на организм человека повышает вероятность развития онкозаболеваний. Факторами такого рода являются: воздействие на организм физических/химических, биологических канцерогенов. Особо важное значение принадлежит воздействию химических канцерогенных веществ (толуол, бензол, мышьяк и др.), ионизирующей радиации, цитостатическим лекарственным препаратам, бытовым факторам (курение, пищевые добавки, выхлопы автомобилей), некоторым РНК- и ДНК-онковирусам. Чаще онкозаболевания развиваются на фоне наследственных/приобретенных дефектов иммунной системы.
Большое значение в развитии лейкозов имеет генетическая предрасположенность: наличие родственников больных острым лейкозом резко повышает риск заболевания. Как передается предрасположенность к онкозаболеваниям? В основе этого процесса лежат генетические патологии/хромосомные аномалии. Так риск заболеть острым лейкозом повышается при болезни Дауна, анемии Фанкони, синдроме Луи-Барра, Вискотта-Олдрича, Клайнфельтера и др.
Симптомы
Острый миелоидный лейкоз у взрослых проявляется преимущественно формированием анемического, геморрагического, инфекционного синдромов, что обусловлено метаплазией нормальной гемопоэтической ткани костного мозга лейкозными бластами, приводящей к выраженной костномозговой недостаточности. Какие-либо специфические симптомы на ранних стадиях ОМЛ отсутствуют. Может иметь место слабость, снижение аппетита, утомляемость, повышение температуры без катарального воспаления, незначительная потеря массы тела. В периоде разгара заболевания симптомы рака крови проявляются:
- Выраженным анемическим синдромомом, который обусловлен подавлением лейкозными бластами эритропоэза и представлен тяжелой метапластической анемией, проявляющейся головокружениями, бледностью кожных покровов, обморочными состояниями.
- Геморрагическим синдромом, в основе которого нарушения со стороны, свертывающей/противосвертывающей систем крови, мегакариопоэза (тромбоцитопения), что выражается петехиальными кровоизлияниями, повышенной кровоточивостью, при ушибах образованием гематом.
- Инфекционным синдромом, который вызван развитием миелотоксического агранулоцитоза, панцитопении, провоцирующих развитие тяжело притекающих вирусных/бактериальных поражений организма (преимущественно герпетических).
- Интоксикационный синдром проявляется анорексией, слабостью, лихорадкой, снижением массы тела вплоть до кахексии, нарастающих при наличии резистентности к цитостатической химиотерапии.
- Гиперпластический синдром характеризуется развитием регионарной/генерализованной лимфаденопатией сплено/гепатомегалией, образованием кожных лейкемидов, гиперплазией десен, что обусловлено образованием/формированием в органах и тканях экстрамедуллярных инфильтратов размножающихся бластов.
- Нейролейкемический синдром. Вызван метастазированием бластов непосредственно в оболочки головного/спинного мозга, что проявляется нарушением мозгового кровообращения и появлением менингеальных симптомов (головная боль, симптом Кернига, ригидность затылочных мышц, парез глазодвигательного/лицевого нервов, парезы нижних конечностей), развитием очаговых поражений ЦНС (расстройства сенсорной/локомоторной функций), бластной инфильтрацией как черепно-мозговых, так и периферических нервов с постепенным формированием болевого синдрома. Бластные пролифераты в суставах/костях вызывают интенсивные боли.
В период ремиссии ОМЛ признаки рака крови минимальны или полностью исчезают. Симптоматика рецидивов аналогична периоду разгара. В терминальном периоде состояние больного прогрессирующе ухудшается и завершается летальным исходом.
Анализы и диагностика
Установление диагноза осуществляется на основании жалоб пациента, его физикального обследования и данных лабораторных анализов. С этой целью проводятся:
- Общий анализ крови. Общий анализ крови при раке является базовым исследованием. По анализу крови определить рак можно с большой долей вероятности. При острых лейкозах в периферической крови содержание бластных клеток может достигать 90–95% всех лейкоцитов. Характерны анемия, панцитопения/тромбоцитопения и специфический признак — лейкемический провал (присутствие в периферическом кровотоке лишь бластных клеточных элементов, при полном отсутствии переходных форм). Для диагноза ОМЛ необходимо наличие в мазке периферической крови 20% или более бластных клеток.
- Биохимический анализ крови. Снижены показатели альбумина, фибриногена, глюкозы и повышены показатели билирубина, мочевины, гамма-глобулинов, ЛДГ.
- Иммунологический анализ на базе моноклональных антител. Этот анализ крови на рак называется зачастую как анализ на онкомаркеры. Заключается в обработке флюоресцентными моноклональными антителами форменных элементов крови и внедрении в кровеносный сосуд с последующей оценкой.
- Цитологическое исследование пунктата костного мозга и оценка миелограммы, позволяющая получить точное представление о характере эритропоэза.
Дополнительно проводятся инструментальные исследования (ЭКГ, КТ головного мозга/органов грудной клетки, УЗИ органов брюшной полости/ внутрибрюшных и периферических лимфоузлов и др.).
Лечение рака крови
Целью является устранение клона, восстановление кроветворения и достижение безрецидивной выживаемости. Можно ли вылечить лейкоз? Это зависит от множества факторов, но основным является цитогенетическая и молекулярная характеристика лейкоза и на основании этого правильно сделанный выбор схемы лечения. В зависимости от цитогенетической и молекулярной характеристики лейкозы бывают с благоприятным, промежуточным и неблагоприятным прогнозом. Максимальная эффективность наблюдается в том случае, если лечить заболевание в зависимости от варианта, строго по разработанным схемам и соблюдая принципы химиотерапии:
- использование адекватных доз цитостатиков;
- использование комбинации препаратов (3-7) для получения большего эффекта и уменьшения риска лекарственной резистентности;
- соблюдение этапности в лечении.
Лечится лейкоз в несколько этапов: индукция ремиссии, консолидация и поддержание ремиссии. Эффективность химиотерапии зависит от специфичности цитостатического препарата и сопроводительного лечения.
Индукция ремиссии достигается полихимиотерапией. Уничтожается основная масса лейкозных клеток. Стандартно при миелолейкозе назначаются даунорубицин или идарубицин, цитарабин и кладрибин. Первый курс индукции проводится по схеме «7+3» — 7 дней вводится цитарабин и 3 дня даунорубицин или идарубицин. Потом или повторяют курс аналогичный первому, или усиливают интенсивность воздействия (высокодозный курс).
Регенерация костного мозга наступает месяц от начала лечения. Критериями полной ремиссии являются наличие бластов в костном мозге менее 5%, отсутствие бластов в крови и экстрамедуллярных изменений. Индукционная терапия одинакова для разных подтипов миелолейкоза, но модифицируется в зависимости от возраста и сопутствующих заболеваний больного. После индукционной терапии ответ на лечение оценивается на 21-27-й день. Если полная ремиссия после проведения двух курсов индукции не достигается, то это устанавливается первичная резистентность, что является плохим долгосрочным прогнозом заболевания. Такие больные после первого курса должны рассматриваться как потенциальные кандидаты на трансплантацию аллогенного костного мозга.
Консолидирующее лечение назначается после достижения ремиссии. Ее цель — устранение лейкемических клеток, которые сохранились, но их нельзя обнаружить обычными исследованиями, а только при помощи проточной цитометрии. Консолидация при миелолейкозе может быть в двух вариантах: химиотерапия и химиотерапия + трансплантация стволовых клеток. В первом случае применяются высокие дозы цитарабина, но в зависимости от группы риска подходы разные:
- проводят 2-4 цикла в группе благоприятного риска;
- в группе неблагоприятного и промежуточного риска лечение проводится до получения лучшей полной ремиссии.
При благоприятном прогнозе — ауто-ТГСК проводят после 2-х циклов консолидации. При неблагоприятном и промежуточном прогнозе возможны варианты:
- аллогенная ТГСК (от совместимого родственного или неродственного донора);
- ауто-ТГСК, если нет донора или есть противопоказания к алло-ТГСК.
Больным с рецидивом после алло- ТГСК может быть рекомендована вторая алло-ТГСК. Поддерживающая терапия при остром миелолейкозе в некоторых клиниках молодым пациентам не назначается, поскольку это не влияет на общую выживаемость. Если же она проводится, то назначаются препараты Цитарабин и Циклофосфамид или Цитарабин +6-меркаптопурин.
Сопроводительное лечение имеет большое значение для повышения эффективности и для выживаемости пациентов. Оно включает:
- Профилактика инфекции. Больного изолируют в отдельной палате или боксе, назначаются фторхинолоны для профилактики бактериальной инфекции, противогрибковые и противовирусные препараты.
- Профилактика синдрома лизиса опухоли. При лейкозах применяется лейкаферез, а также увеличивается объем жидкости до 3-4 л.
- Борьба с гиперлейкоцитозом предусматривает немедленное начало индукционной терапии или применение гидроксимочевины.
- Устранение анемии и тромбоцитопении. По показаниям переливается эритроцитарная масса и тромбоконцентрат.
- Рациональное питание (возможно энтеральное или парентеральное).
- Лечение тошноты и рвоты.
Излечим или нет лейкоз? В последние годы разработано патогенетическое лечение некоторых видов — излечим хронический миелоидный лейкоз и острый промиелоцитарный. Выздоровевшим считают больного, у которого отмечается клинико-гематологическая ремиссия после полного курса терапии на протяжении 5 лет. У 60-70% с острым миелолейкозом после полной ремиссии в ближайшие 3 года развивается рецидив.
Терапевтических подходов к лечению рецидива мало и прогноз после рецидива неблагоприятен. Выживаемость зависит от возможности достичь повторную ремиссию и провести трансплантацию костного мозга. Больные с ранним рецидивом (ремиссия меньше полгода), цитогенетическими аномалиями имеют плохой прогноз.
Часто встречается вопрос, помогает ли чистотел при лейкозе? Нами рассмотрены схемы лечения, в которых серьезные препараты применяются длительно, чередуются и не всегда достигается результат, поэтому применять чистотел для лечения данного заболевания нецелесообразно.
Доктора
Лекарства
- Цитостатики: Даунорубицин-Лэнс, Рубомицин, Рубида, Цитарабин-Лэнс, Цитозар, Кладрибин, Веро-Кладрибин, Винкристин-Рихтер, Веро-Винкристин, L-аспарагиназа, Циклофосфан, Лейковорин Лахема, Келикс, Доксорубицин-Лэнс.
- Антибиотики: Азитромицин, Амоксициллин/клавулановая кислота, Моксифлоксацин, Офлоксацин, Ципрофлоксацин, Метронидазол.
- Противогрибковые препараты: Вориконазол, Итраконазол, Каспофунгин, Флуконазол.
Процедуры и операции
Трансплантация гемопоэтических стволовых клеток может быть аутогенной (используются собственные клетки больного) или аллогенной (используются клетки донора). Аутологичная трансплантация может использоваться у больных группы промежуточного риска в том случае, если отсутствует донор или как этап перед аллогенной трансплантацией. Однако при низкой чувствительности опухолевых клеток к химиопрераратам (отсутствие ремиссии) эффективность аутологичной трансплантации не отличается от химиотерапии.
Забор стволовых клеток проводится из:
- костного мозга;
- периферической крови;
- пуповинной крови (используется у детей).
Периферическая кровь, как источник стволовых клеток, заменила костный мозг, особенно при аутотрансплантации. Проводить забор стволовых клеток из крови легче, кроме того, происходит быстрее восстановление нейтрофилов и тромбоцитов.
Для того, чтобы получить стволовые клетки из крови, донору вводят факторы роста, которые стимулируют их выход в кровь, а через 4-6 дней проводят аферез. После чего для выделения стволовых клеток проводят флуоресцентно-активированную сортировку. Полученные стволовые клетки вводят больному через центральный венозный катетер в течение 1-2 часов. Перед аллогенной трансплантацией, для того чтобы не произошло отторжения, больному назначают режим кондиционирования — назначение циклофосфамида внутривенно в течение 2 дней и облучение всего тела, или же таблетки бусульфан в течение 4 дней + циклофосфамид. Режим кондиционирования не проводится до проведения аутогенной трансплантации.
После трансплантации больному назначаются колониестимулирующие факторы с целью сокращения периода посттрансплантационной лейкопении, а также лекарственные препараты для защиты от инфекций. В случае аллогенной трансплантации назначается курс иммуносупрессантов (метотрексат и циклоспорин) на 6 месяцев. Приживление трансплантата происходит через 10-20 дней после трансплантации стволовых клеток, полученных из костного мозга, а при трансплантации стволовых клеток из крови — еще раньше.
Трансплантация аллогенных гемопоэтических стволовых клеток больным миелоидным лейкозом группы высокого и промежуточного риска проводится во время первой ремиссии, как следующий этап лечения.
Наибольший эффект трансплантации достигается при выполнении ее в первой ремиссии и от родственного донора. Проведение трансплантации стволовых клеток от неродственного донора оправдано при первой ремиссии у больных группы высокого риска. Трансплантация, проведенная в первой ремиссии, имеет максимальную эффективность. Отмечаются плохие результаты аллоТГСК у больных вне ремиссии или в более поздних стадиях заболевания (например, после третьей ремиссии). Высокая эффективность близкородственной трансплантации отмечается при хроническом миелоидном лейкозе, поскольку она способствует длительной молекулярной ремиссии и для поддержания ее не требуется назначение химиопрепаратов.
Рак крови у детей
Особенностями лейкозов у детей являются:
- Преобладание острых лейкозов.
- Из острых чаще всего встречается лимфобластный, который составляет 85% случаев.
- Пик заболеваемости от 2 до 5 лет, при этом мальчики болеют чаще.
- Высокая эффективность лечения острого лимфобластного лейкоза (пятилетняя выживаемость 85%).
- Смертность в возрасте 2-4 года.
Острый лимфобластный лейкоз — это заболевание, при котором появляются злокачественно измененные лимфоидные предшественники — лимфобласты. Термин «острый лимфобластный лейкоз» подразумевает генерализованный процесс с вовлечением крови и костного мозга. Критерий острого лейкоза — обнаружение лимфобластов в пунктате более 25%. Если лимфобластов менее 20%, то это лимфобластная лимфома. Костный мозг для анализа забирается из 3-4-х точек передних и задних крыльев подвздошных костей.
Симптомы острого лимфолейкоза зависят от степени насыщения костного мозга лимфобластами. Симптомы рака крови у детей первое время неспецифичны: повторные инфекционные заболевания, потеря аппетита, слабость, утомляемость, недомогание. Потом появляется лихорадка, боли в костях/суставах, кровоточивость слизистых (кровотечения носовые, десневые), кровоизлияния на коже. Распространение бластных клеток в лимфоузлы и внутренние органы сопровождается увеличением печени, селезенки и лимфоузлов, что проявляется болями в животе и сдавлением средостения лимфоузлами. Нейролейкемия проявляется поражением черепно-мозговых нервов и менингеальными симптомами. Наиболее часто встречающиеся признаки — изменения в крови (анемия, тромбоцитопения) и частые инфекции.
Для повышения эффективности полихимиотерапии у детей необходимо проводить иммунофенотипирование бластных клеток (система HLA). Иммунофенотипирование проводится методом проточной цитофлуориметрии (исследуется костный мозг) По распространенности у детей чаще встречается В-лимфобластный лейкоз 80-85%, чем Т-лимфобластный 15-20%. Лечение начинается сразу после того, как установлен диагноза и проводится по протоколу. Изменение доз, пропуск препарата или отмена не допустимы. Доза рассчитывается на квадратный метр поверхности тела. Вводятся препараты в центральный венозный катетер. В основе лечения — комбинация препаратов и соблюдение интервалов между курсами химиотерапии.
В России применяют протоколы BFM или группы Москва-Берлин. По протоколам больных делят на группы: стандартного, промежуточного и высокого риска и больные получают разные варианты лечения.
Лечение детей состоит из фаз:
- индукция ремиссии (4 и более препаратов, которые вводятся 4-6 недель);
- консолидация;
- поддерживающее лечение (назначаются антиметаболиты 2-3 года).
Для индукционной терапии применяется преднизолон, даунорубицин, винкристин, цитарабин, L-аспарагиназа, 6-меркаптопурин, циклофосфамид. Лечение проводится в стационаре. Для повышения эффективности используют 4-компонентную терапию. В течение курса лечения у больных развиваются тяжелые осложнения. Эффективность лечения проверяется на 8 день (анализ крови), на 15 день (анализ костного мозга) и по окончании индукции (анализ костного мозга). Дети, прошедшие индукционную терапию не достигшие ремиссии, становятся пациентами высокого риска.
Дети, достигшие ремиссии, получают консолидирующую терапию. При отсутствии осложнений лечение может проводиться дневном стационаре. Если по протоколу используются высокие дозы метотрексата, дети должны находиться в стационаре круглосуточно. Консолидирующая терапия, включает несколько фаз. Перед началом каждой фазы проводится клинический и биохимический анализ крови. Консолидирующее лечение включает метотрексат, 6-меркаптопурин, L-аспарагиназу.
Поддерживающая терапия предусматривает прием 6-меркаптопурина (каждый день) и метотрексата (раз в неделю) и проводится в течение 2-х лет, считая от начала индукции. Условие правильного проведения поддерживающего лечения — коррекция дозировки препаратов в зависимости от уровня лейкоцитов (их уровень должен быть 2 000-3 000/мкл).
Протоколы группы Москва-Берлин предусматривают проведение реиндукций (дексаметазон + винкристин) на фоне поддерживающей терапии каждые полгода. В течение всего периода поддерживающей терапии ребенок должен сдавать клинический анализ крови 1 раз в неделю, а после окончания ее – 1 раз в месяц. УЗИ органов брюшной полости выполняют 1 раз в 3 месяца. Ребенок наблюдается у педиатра, а гематолог осматривает его 1 раз в 3 месяца. Ребенок снимается с учета при окончании поддерживающего лечения, наличия ремиссии в течение 5 лет.
Трансплантация костного мозга дает наилучшие результаты в отношении увеличения сроков выживаемости. Проведение трансплантации показано всем детям высокого риска в период первой ремиссии в максимально ранние сроки. Поэтому поиска донора проводятся сразу после установления группы высокого риска.
Показания для аллогенной трансплантации детям высокого риска:
- плохой ответ на преднизолон + лейкоцитоз более 100 х 10 в 9/л + определенные генетические изменения;
- отсутствие ремиссии на 33 день лечения;
- к 15 дню индукции наличие более 25% бластов в костном мозге у детей высокого риска рецидива.
Диета
Питание больных должно быть высоко энергетичным, богатым витаминами и микроэлементами.
Профилактика
Не существует специфической профилактики лейкозов. При данном заболевании важны общие принципы: сведение к минимуму рентгеновских исследований, ограничение контакта с химическими веществами, здоровый и активный образ жизни.
Для ранней диагностики важно проходить профилактические осмотры врача и обследования, обязательно включающие клинический анализ крови с подсчетом лейкоцитарной формулы. Нельзя оставлять без внимания даже незначительные отклонения в состоянии здоровья: усталость, боли в костях, снижение веса, ухудшение аппетита, наличие спонтанных синяков на коже.
Последствия и осложнения
- Инфекционные осложнения, характер которых различен в зависимости от длительности нейтропении.
- Диагностируются лихорадка неясной этиологии, различные инфекции (бронхопневмония, сепсис, инфекция кожи, некротичекие повреждения слизистых рта) и инвазивный аспергиллез. При увеличении периода нейтропении частота инфекционных осложнений возрастает.
- Тяжелые осложнения в виде кровотечений, в том числе и геморрагии в стенке кишечника, кровоизлияний в головной мозг, связанные с тромбоцитопенией, часто оказываются смертельными.
- Инфильтрация внутренних органов лейкемическими клетками, что вызывает увеличение лимфоузлов, селезенки или печени, снижение зрения, поражение дыхательных путей, нарушения сердечного ритма и сердечную недостаточность, боли в костях, появление крови в моче, остеонекроз, инфильтраты в кишечнике, которые становятся причиной кишечной непроходимости. Лейкемические клетки, накапливаясь в крови, вызывают расстройства кровообращения, что приводит к инфарктам и инсультам.
- Развитием аутоаллергических процессов, которые приводят к гемолитической анемии и выраженной гранулоцитопении.
Причинами смерти становятся осложнения, которые не совместимы с жизнью: бронхопневмония, сепсис, кровоизлияние в головной мозг, постгеморрагические анемии при сильных желудочно-кишечных кровотечениях.
Прогноз
Ответить на вопрос «сколько живут с раком крови» трудно. Это зависит от многих факторов, прежде всего от вариантов острого лейкоза. Если рассматривать острый миелоидный лейкоз, прогноз зависит от цитогенетической и молекулярной характеристики заболевания, возраста больного и применяемого лечения. Шансы на излечение имеются у больных не старше 60 лет, которые имеют благоприятные цитогенетические изменения без молекулярных изменений, лечение быстро привело к полной ремиссии и у больных отсутствуют экстрамедуллярные очаги (не поражена печень, селезенка, лимфатические узлы).
Только полихимиотерапия приводит к выздоровлению в 90% при промиелоцитарном лейкозе (подтип миелолейкоза) и 50% при формах с благоприятным прогнозом у лиц до 60 лет. При других вариантах миелолейкоза и у лиц старше 60 лет вылечиваются только 10-15% больных. Применение ауто-ТГСК увеличивает до 40% пятилетнюю выживаемость больных среднего риска. Применение алло-ТГСК вылечивает более 60% пациентов. В группе неблагоприятного риска результаты лечения остаются неудовлетворительными. Пятилетняя выживаемость отмечается только у 10% в возрасте старше 60 лет.
Существует больше 20 вариантов острого В-лимфолейкоза, включая лейкозы с генетическими аномалиями (повторяющиеся генные аберрации, наличие слитных генов), которые в значительной степени влияют на течение заболевания, чувствительность к специфической терапии и прогноз. Острый В-лимфолейкоз с формированием гена BCR-ABL1 встречается у 25% взрослых. Выявление гена BCR-ABL1 сопряжено с очень неблагоприятным прогнозом, высоким риском рецидивов и вызывает необходимость применения специфической высокодозной полихимиотерапии. Острый В-лимфолейкоз с реаранжировками гена MLL отмечается у 80% грудных детей до 6-месяцев и отличается плохим прогнозом. Неблагоприятный прогноз при остром В-лимфолейкозе отмечается:
- при лейкемической форме;
- у новорожденных детей и старше 10 лет;
- при отсутствии ответа на лечение;
- при остаточной болезни после курса лечения;
- при возникновении ранних рецидивов.
В любом случае, острый лейкоз без лечения заканчивается летально. Без химиотерапии больные погибают за 3 месяца от сопутствующих инфекций или кровотечений. В настоящее время достигнуты успехи в лечении лейкозов, поскольку применяется полихимиотерапия, пересадка костного мозга и применяются таргетные препараты (биологические препараты, избирательно действующие на сигнальные пути, и прекращают опухолевый рост).
У детей при В-остром лимфолейкозе ремиссия достигается в 95% случаев, а у взрослых — в 65-85%. Пятилетняя выживаемость с острым лимфолейкозом составляет 85-90%. Что касается хронических лимфолейкозов, то продолжительность жизни при них тоже зависит от генетического варианта. Немутированный В-ХЛЛ имеет прогрессирующее развитие, крайне тяжелое течением и малую продолжительность жизни, несмотря на лечение больные живут до 8 лет.
Мутированный хронический В-лимфолейкоз медленного течения и средняя выживаемость составляет 25 лет.
Список источников
- Гематология: национальное руководство / Под ред. Рукавицына О.А. — М.: ГЭОТАР-Медиа; 2015. — 776 с.
- Программное лечение заболеваний системы крови, под ред. Савченко В.Г. М.: Практика; 2012: 155—245.
- Савченко В. Г., Паровичникова Е.Н. Глава «Острые лейкозы» в книге «Клиническая онкогематология», под ред. Волковой М. А., М.: Медицина; 2001: 156-207.
- Гуляева И.Л., Веселкова М.С., Завьялова О.Р. Этиология, патогенез, принципы патогенетической терапии лейкозов // Научное обозрение. Педагогические науки. – 2019. – № 5-3. – С. 47-50.
- Рациональная фармакотерапия заболеваний системы крови / Под общей редакцией Воробьева А.И. // М.: «Литтерра», 2009 г. – 688 с.





 Циклофосфан
Циклофосфан Метотрексат
Метотрексат Азитромицин
Азитромицин Моксифлоксацин
Моксифлоксацин Офлоксацин
Офлоксацин Вориконазол
Вориконазол Флуконазол
Флуконазол














Последние комментарии
Людмила: Я пью квестран длительное время от хологенной диареи, скажите повышает ли препарат ...
Лилия: Где можно купить ма азь Проспидин
Гость: Напишите кто принимал инвермектин в уколах от паразитов, как рассчитывали дозу?
Мария: Посоветовала коллега, когда дочь болела, что ночью просыпалась и не могла спать из-за ...