Миеломная болезнь (миелома)
Общие сведения
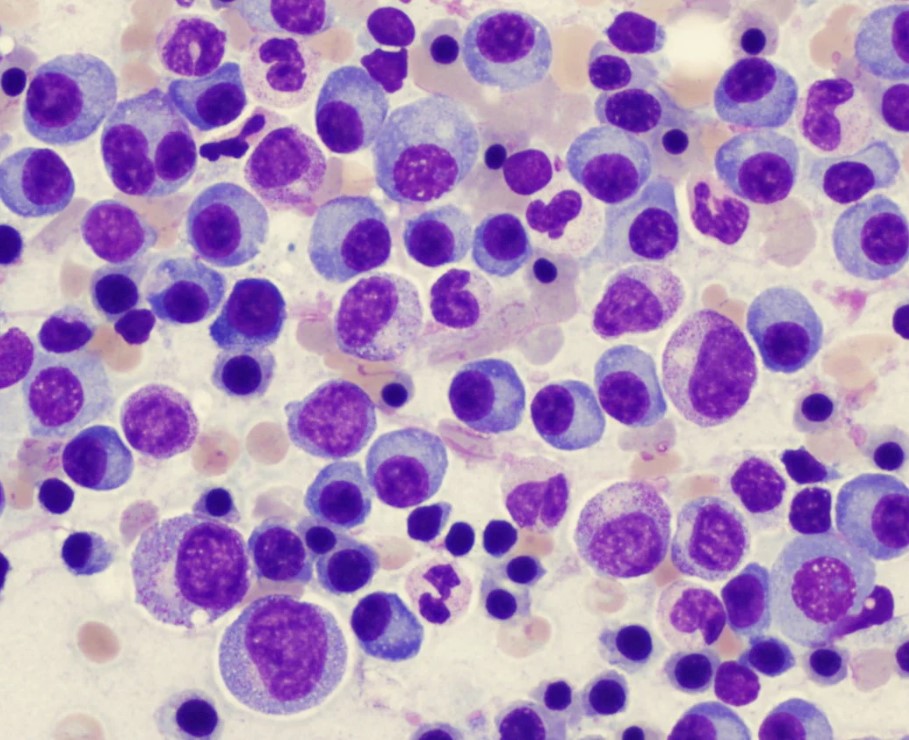
Множественная миелома или миелома, что это за болезнь? Это онкогематологическое заболевание, которое характеризуется неконтролируемым размножением клональных плазматических клеток.
Плазматические клетки сосредотачиваются в костном мозге, костях (при этом идет разрушительный процесс) и внутренних органах (нарушается их функция). Поражение костей скелета обширно и локализуется в черепе, костях таза, ребрах, позвоночнике. Деструкция кости сопровождается не только болью, но и спонтанными переломами. Плазматическая клетка — это дифференцированный В-лимфоцит, который участвует в продукции антител в формировании иммунитета.
Опухолевой плазматической клеткой в большом количестве синтезируется моноклональный иммуноглобулин (его называют М-белок или М-комплекс, обнаруживают в крови и моче). Структура его не нарушена, но синтез его превосходит физиологические нормы. Множественная миелома считается болезнью старшего возраста. Максимальная встречаемость приходится на 50-70 лет. Однако может встречаться и у молодых. Больные моложе 40 лет составляют 5-10%. Мужчины болеют чаще. Синонимами данного заболевания являются миеломатоз и плазмоклеточная миелома — на этот термин изменен термин «множественная миелома». Миеломная болезнь МКБ-10 кодируется как C90.0.
Патогенез
Развитие плазмоклеточной миеломы происходит на уровне ранних предшественников В-лимфоцитов и первично трансформированные клетки дифференцируются до плазматических клеток (конечный этап). По мере созревания они начинают секретировать иммуноглобулины. Опухолевые клетки имеют свои закономерности роста. На ранних стадиях рост опухоли через 2-3 дня удваивается. В период ее клинического обнаружения масса составляет 1 кг/м2, при этом количество быстро растущих клеток уменьшается. Рост опухоли иногда останавливается при меньшей массе, тогда отмечается спокойное и длительное течение. В миеломных клетках и окружающей ткани функционируют сигнальные системы.
М-протеин, который продуцируют плазматические клетки, чаще всего относится к IgG, а также к IgА. Но независимо от их вида у 40% больных развивается протеинурия Бенс-Джонса (в моче обнаруживают моноклональные легкие цепи). У 20% больных злокачественные клетки секретируют только этот белок Б-Д, а при несекреторной форме M-белок в моче и крови вообще не обнаруживают. Для болезни характерным является развитие остеопороза чаще всего в костях таза, позвонках и ребрах. Это связано с тем, что нормальная кость замещается растущей опухолью, а цитокины, секретируемые злокачественными клетками, активизируют остеокласты, разрушающие кость. Увеличенная потеря кости сопровождается повышением кальция в крови.
Внекостные плазмоцитомы могут встречаться в верхних отделах дыхательного тракта. У многих больных уже на момент постановки диагноза есть почечная недостаточность, которая развивается в связи с отложением легких цепей в канальцах почек, а также с повышенным уровнем кальция в крови. Анемия связана с заболеванием почек и подавлением эритропоэза.
Классификация
Среди плазмоклеточных опухолей выделяются:
- Множественная миелома.
- Плазмоклеточная миелома и ее варианты (асимптоматическая, плазмоклеточный лейкоз несекретирующая).
- Плазмоцитома.
По активности заболевание бывает:
- «Тлеющая» (бессимптомная). Данная форма не проявляется характерными для заболевания симптомами (нет очагов разрушения костей и поражения внутренних органов). М-компонент больше 30 г/л или же количество плазматических клеток в костном мозге больше 10%. Риск прогрессии в симптоматическую большой.
- Активная миелома. Отмечается активный рост опухоли, остеодеструкция, повышенная вязкость крови, появляются инфекционные осложнения.
По клинико-анатомической классификации множественная миелома бывает нескольких форм:
- Диффузная.
- Множественно-очаговая.
- Диффузно-очаговая форма.
- Преимущественно-висцеральная.
Множественная миелома (код по мкб-10 C90.0) имеет стадии, которые различаются по степени продукции патологического белка:
- I стадия. Низкая продукция М-белка (IgG меньше 30 г/л), масса опухоли до 600 г/м2, белок Б-Д меньше 4 г/с, нормальное строение костей или есть один очаг.
- II стадия. Масса опухоли 600-1200 г/м2 и скорость продукции М-комплекса средняя.
- III стадия. Низкий уровень гемоглобина, кальций повышен, поражения костей множественные, IgG больше 70 г/л, а белок Б-Д выше 12 г/сутки.
Заболевание крови миелома может протекать спокойно и симптоматически с поражением костей, подавлением костного мозга и почечной недостаточностью. Симптоматическая миеломная болезнь крови отличается высокой продукцией парапротеина и она соответствует «развернутой» картине заболевания и обязательно требует лечения. Нарушение функции почек всегда присутствует и в зависимости от уровня креатинина все больные делятся на три группы для определения прогноза.
Основные критерии заболевания:
- Выявление в костном мозге более 10% плазматических клеток или развитие плазмоклеточной опухоли.
- Наличие моноклонального иммуноглобулина, который продуцируется злокачественными клетками.
- Определяется он при электрофорезе белков крови. В практике ориентируются на значение 30 г/л IgG. необходимо контролировать уровень M-протеина постоянно, поскольку повышение его является фактором прогрессии.
- Нередко у больных моноклональный иммуноглобулин отсутствует, но отмечается снижение уровня гаммаглобулина в крови и при исследовании мочи отмечается выделение легких к-цепей.
При повреждении органов и тканей параллельно развиваются:
- Повышается уровень кальция.
- Нарушается функция почек (основной критерий повышение креатинина).
- Развивается анемия.
- Поражение костей (компрессия тел позвонков, лизис, переломы).
Поражение при миеломе носит диффузный и очаговый характер. При диффузной форме поражается только костный мозг, и эта форма выявляется в 24% случаев. Диффузно-очаговая форма множественной миеломы представляет собой смешанный вариант и сочетает наличие опухолевого роста в организме и поражение костного мозга. Данный вариант встречается чаще всего.
О несекретирующей миеломе говорят тогда, когда в костном мозге выявляются плазматические клетки и есть признаки поражения органов. Но при этой форме нет моноклонального белка в крови и моче, поэтому почечная недостаточность развивается редко.
Асимптоматическая форма или тлеющая. Для нее характерны следующие критерии: М протеин более 30 г/л, в моче 500 мг парапротеина или более 10% плазматических клеток в костном мозге. При этом нет поражений органов и костей, а также отсутствует амилоидоз. Лечение в данном случае не проводится, но больные наблюдаются раз в квартал (определяется парапротеин в крови и моче). Обычно промежуток до прогрессии заболевания составляет 4 года.
Плазмоцитомы — это плазмоклеточные опухоли. В зависимости от локализации бывают они костными (костная плазмоцитома) и экстрамедуллярными (поражаются мягкие ткани). Солитарная плазмоцитома представлена единичным очагом в кости или тканях (бывает, что продукция М-белка низкая). Диагноз костной плазмоцитомы устанавливается, если опухоль расположена в кости и нет других системных признаков. Заболевание чаще встречается у молодых лиц. Солитарные очаги располагаются в позвонках (плазмоцитома позвоночника) и трубчатых костях. Больных беспокоят боли в поврежденных костях и патологические переломы. При солитарной плазмоцитоме применяется рентгенотерапия. В 50% в течение 3 лет отмечается трансформация в множественную миелому.
Плазмоцитома кожи или экстрамедуллярная миелома кожи имеет благоприятное течение. Поражение кожи при экстрамедулярной миеломе встречается у 4% больных. В отличие от множественной миеломы плазмоцитома кожи протекает без поражения костного мозга и органов. Если отсутствует гиперкальциемия и не вовлекается костный мозг, то продолжительность их жизни может достигать 10 лет. Но имеются наблюдения, когда при кожной миеломе через несколько лет развивается системный миеломатоз. Также бывают противоположные случаи — миелома метастазирует в кожу из костного мозга. Данный факт рассматривается как неблагоприятный признак, и продолжительность жизни больных может составлять 1,5-12 месяцев.
Причины
Возникновение множественной миеломы является сложным процессом, который включает сочетание внешних и внутренних факторов. Разрешающими факторами для развития болезни являются:
- Длительная антигенная стимуляция, которая развивается после вирусных инфекций и хронических заболеваний.
- Воздействие радиации и токсических веществ.
- Инфицированность 8 типом вируса герпеса.
- Если рассматривать генетический фактор, то при генетических изменениях формируется клон плазмоцитов, который продуцирует иммуноглобулин. Последовательность генетических событий в клональных клетках вызывает их бесконтрольное деление и прогрессирование зародившейся опухоли. Хромосомные транслокации — это основной фактор, который активирует протоонкогены. При множественной миеломе обнаруживаются сложные комбинации изменений хромосом (по количеству и структуре). Клинические проявления заболевания связаны с генетическими изменениями, а на прогноз влияют мутации онкогенов K-ras и N- as. При беседе с больным уделяется внимание семейному анамнезу — обычно история болезни их включает родственников, которые имеют гематологические заболевания — лимфомы и хронический лимфолейкоз.
Симптомы миеломной болезни
Длительность заболевания до того, как появятся первые симптомы, может быть от месяцев до 3 лет. Множественная миелома отличается от других заболеваний крови тем, что симптомы миеломной болезни разнообразны, поскольку сама опухоль и ее продукты вызывают многочисленные изменений в различных органах. У 20% больных признаки миеломной болезни отсутствуют (бессимптомное течение), но появляется увеличенная СОЭ. Потом появляются боли в костях, слабость и похудание. Боли в костях — наиболее частый признак и встречаются у 70% пациентов и появляется очень рано.
Часто заболевание начинается внезапно с появления боли в скелете или перелома. Очаги костных изменений на рентгенограмме определяются как лизис (разрушение кости). Разрушение кости связано с разрастанием клона опухоли, кроме того, активируются остеокласты. Такой процесс прежде всего развивается в плоских костях (это череп, грудина, ребра, тазовые кости) и позвоночнике. Разрушение позвонков проявляется корешковым синдромом в разных отделах позвоночника.
Боли беспокоят больного при движении, а метастазы различных опухолей в кость усиливаются ночью. Постоянные локальные боли свидетельствует о переломах. Лизис костей и разрастание опухолевой массы настолько выражены, что опухоли пальпируются на черепе или грудине. Лизис костей сопровождается потерей кальция из костной ткани и повышением кальция, а также фосфора в крови. Данным фактом объясняется появление сонливости, тошноты и рвоты.
Оседание позвонков сопровождается компрессией спинного мозга («коллапс позвоночника»), а поражение в области конского хвоста нарушает работу тазовых органов. Сдавление спинного мозга сопровождается потерей чувствительности, слабостью мышц рук и ног, парезами и плегиями. Нейропатия (жжение, покалывание в руках и ногах, нарушение чувствительности) связано с пропитыванием нервов амилоидом.
Патология почек отмечается у 50% больных и связана она с фильтрацией в клубочках патологического белка (так называемые, легкие цепи), который выделяется с мочой. Большое количество их повреждает канальцы и приводит к почечной недостаточности, которая сокращает продолжительность жизни. Диагностически значимым является креатинин крови больше 173 ммоль/л. Также отмечается инфильтрация почек плазматическими клетками, поэтому почки увеличиваются в размерах. Высокое содержание кальция приводит к психическим расстройствам и состоянию комы. Гиперкальциемия рассматривается как одна из причин недостаточности функции почек. Частым признаком является склонность к бактериальным инфекциям. Повышенная вязкость крови сопровождается головной болью, нарушением зрения и изменениями на глазном дне.
Развитие анемии объясняется замещением гемопоэза плазматическими клетками. Наличие анемии иногда становится поводом к поиску ее причины, а проведя другие исследования устанавливается правильный диагноз.
Диагноз устанавливается по повышению общего белка, бека в моче, анемии или наличию почечной недостаточности.
Анализы и диагностика миеломной болезни
- Общий анализ мочи. Выявляет только наличие белка в моче.
- Электрофорез и иммунофорез мочи, который позволяет выявить легкие цепи и количественно их оценить.
- Для выполнения анализа мочу собирают сутки. У 20% больных в моче (и крови) выявляются только легкие цепи — ставится диагноз «миелома легких цепей».
- Клинический анализ крови. В начальной стадии изменений в крови может не быть, но при генерализации процесса развивается нормохромная анемия, иногда являющаяся основным проявлением болезни.
- Характерным симптомом является резкое увеличение СОЭ до 60-90 мм/ч.
- Биохимический анализ крови (кальций, креатинин, мочевина, мочевая кислота, натрий, калий, общий белок и фракции).
- Определение уровня моноклонального иммуноглобулина (парапротеин). Это полноценный иммуноглобулин, который состоит из легких и тяжелых цепей. При миеломе чаще выявляется повышенная секреция иммуноглобулина IgG.
- Уровень свободных легких цепей иммуноглобулинов в крови (СЛЦ каппа и лямбда), который повышается при множественной миеломе. Опухолевые клетки при миеломе секретируют легкие цепи иммуноглобулинов, поэтому не происходит их полноценной сборки. Свободные легкие цепи называются белком Бенс-Джонса. Миеломная болезнь, при которой вырабатываются только легкие цепи, называется миеломой Бенс-Джонса.
- Определение легких цепей иммуноглобулинов в моче (белок Бнс-Джонса).
- Диагностика обязательно включает пункцию костного мозга — один из ведущих методов. В костномозговом пунктате определяется обилие плазматических клеток. Диагноз достоверен при обнаружении более 10% клональных плазматических клеток.
- Цитогенетическое исследование для выявления хромосомных изменений.
- Рентгенография костей (позвоночник, череп, таз, плечевые и бедренные кости).
- МРТ позвоночника или таза проводят больным при подозрении на солитарную плазмоцитому или компрессию спинного мозга.
- Для оценки тяжести остеопороза используют сцинтиграфию.
Лечение миеломы
Множественная миелома трудно поддается лечению и даже после полноценного курса может быстро рецидивировать. Больным с симптоматической миеломой сразу проводится противоопухолевая терапия, а при тлеющей форме лечение не рекомендуется, но больной должен наблюдаться у врача и обследоваться. В целом лечение направлено на подавление роста опухоли, улучшение качества жизни и продолжительности жизни.
Трудности в лечении связаны с тем, что часть опухолевых клеток резистентна к противоопухолевым средствам.
Тактика лечения определяется индивидуально. Лечение миеломной болезни предусматривает различные схемы химиотерапии, основными являются:
- МР (мелфалан+преднизолон).
- СVМР (циклофосфамид+ мелфалан + винкристин + преднизолон).
- MPТ (мелфалан + преднизолон + талидомид).
- М2 (мелфалан + циклофосфамид + ломустин + винкристин + преднизолон).
С каждым годом появляются новые препараты, по эффективности превосходящие предыдущие. Чувствительность к химиотерапии — это важный прогностический критерий. При генетической резистентности к химиотерапии рекомендуется препарат Велкейд (бортезомиб), который дает высокую эффективность при разных стадиях заболевания. Его включают в схемы терапии VMP (велкейд мелфалан +преднизолон+), VТP (велкейд + талидомид+ преднизолон), VMPТ (велкейд + мелфалан + талидомид + преднизолон), VD (велкейд + дексаметазон), VCD (велкейд + циклофосфамид + дексаметазон), PAD (велкейд + доксорубицин + дексаметазон).
Множественная миелома хорошо лечится по схемам, которые включающие Велкейд, который считаются самыми эффективными.
Больным до 65 лет с впервые выявленной миеломой, которым планируется аутоТГСК, как индукционную терапию применяют один из режимов — VCD, PAD или VD. После трансплантации через 3 месяца, если нет прогрессии заболевания, назначается консолидирующая терапия двумя или тремя курсами VCD или VRD. Как вариант консолидации рассматривается вторая (тандемная) аутоТГСК. Также доказано значение поддерживающего лечения, которое назначается после первой или второй аутоТГСК. Могут применяться ингибитор протеасомы Велкейд внутривенно или подкожно каждые 2 недели два года подряд и иммуномодулятор Ревмилид в капсулах ежедневно в течение 1−2 лет.
Если первично больной не показал результат на режимы с Велкейдом, во второй линии применяются леналидомидсодержащие режимы:
- RD (Ревмилид + Дексаметазон).
- VRD (Велкейд+ Ревмилид + Дексаметазон).
- RCD (Ревмилид+ Циклофосфан +Дексаметазон).
- RCP (Ревмилид+ Циклофосфан + Преднизолон).
Ревлимид оказывает иммуномодулирующее действие, вызывает апоптоз (гибель) плазматических клеток и блокирует ангиогенез опухоли. Эффективно применение Ревмилида с дексаметазоном, что усиливает апоптоз патологических клеток.
Рецидивы при миеломе наступают неизбежно. Признаками рецидива являются:
- Гиперкальциемия.
- Почечная недостаточность.
- Анемия.
- Поражения костей.
Выбор программы при рецидиве зависит от эффективности предыдущего лечения, продолжительности ремиссии и возраста больного. При рецидиве через год после окончания лечения (считается поздним рецидивом) часто возобновляют первичное лечение. При ранних рецидивах программу лечения меняют.
Форум больных подтверждает возможность рецидивов. Некоторые проходят 7 курсов химиотерапии и по 2 аутотрансплантации, при этом через 1 год болезнь рецидивирует. После повторного проведения 5-ти курсов химиотерапии и донорской пересадки ремиссия отмечается в течение 5 лет. Судя по отзывам пациентов, после применения препарата Велкейд у многих развивается нейропатия нижних конечностей — появляются сильные боли. Рассмотрев сложности лечения данного заболевания с возможность рецидивирования можно сказать, что лечение миеломы народными средствами не эффективно и не должно применяться.
Доктора
Лекарства
- Противоопухолевые препараты: Велкейд, Циклофосфан, Доксорубицин, Алкеран, Рибомустин, Кипролис, Нитро.
- Иммуномодуляторы: Имновид, Ревмилид.
Процедуры и операции
Локальная лучевая терапия проводится при опухолевых узлах в костях или мягких тканях. Лучевая терапия показана при болях в связи со сдавлением спинного мозга и при угрозе переломов костей из-за прорастания опухолью. Малые дозы облучения не применяются, поскольку повышается возможность рецидива в 5 раз в зоне облучения.
Больным проводятся повторные процедуры гемосорбции, гемодиализа или плазмафереза, которые удаляют избыток патологического белка, препятствуют парапротеинемической коме и уменьшают риск развития почечной недостаточности.
Аутологичная трансплантация стволовых клеток применяется у больных пациентов при нормальной функции органов и стабильном течении заболевания, а также если имеется хороший ответ на лечение.
Первую аутологичную трансплантацию выполняют всем, у кого удалось собрать стволовые клетки. Она проводится в течение года с начала лечения, а эффективность ее оценивается через 1,5 месяца. Повторная аутотрансплантация проводится при прогрессировании. Для решения вопроса о второй аутотрансплантации учитывают ответ на проведенное лечение и эффективность первой трансплантации. Если эффект после первой трансплантации не увеличивается, проводится вторая, но меняется режим консолидирования.
Как проводится подготовка к сбору стволовых клеток? После достижения ремиссии у больных собирают гемопоэтические стволовые клетки. Перед этим проводится мобилизация их циклофосфамидом и гранулоцитарным колониестимулирующим фактором. Если есть возможность, то ауто-ТГСК собирают для проведения двух трансплантаций.
У детей
Случаи множественной миеломы у детей считаются редкостью, поскольку в детском возрасте она встречается в 140 раз реже. Диагностика этого заболевания у детей затруднена из-за редкой встречаемости в этом возрасте и сниженной настороженности врачей. Диагноз устанавливается при обнаружении миеломных клеток в костном мозге и типичной рентгенологической картине. Клиническая картина не отличается от таковой у взрослых, но у детей чаще вовлекаются лимфатические узлы, что связано с генерализацией процесса. Течение заболевания у детей неуклонно прогрессирующее. Средняя длительность жизни 2-3 года.
Диета

Диета 15 стол
- Эффективность: лечебный эффект через 2 недели
- Сроки: постоянно
- Стоимость продуктов: 1600-1800 рублей в неделю
Питание при данном заболевании должно быть полноценным по основным нутриентам и иметь достаточную энергетическую ценность. В рационе важен полноценный белок в достаточном количестве (говядина, птица, кролик, индейка, печень, рыба, творог). Больной должен получать ежедневно 2 грамма белка на килограмм веса.
Из мясных продуктов готовят паровые биточки, тефтели или котлеты. Источниками кальция становятся кисломолочные продукты, творог, семена подсолнечника и кунжута. Ежедневный рацион должен включать продукты, содержащие витамины и B и C, а с учетом анемии — богатые железом (говядина, говяжья печень, гранат). Питание должно быть дробным — порции небольшие для лучшего переваривания и исключения перегруза пищеварения.
Простые углеводы исключаются, поскольку на фоне приема дексаметазона и преднизолона может повыситься уровень сахара. Не стоит употреблять жирую, жареную и острую пищу, жирное молоко и сливки, наваристые супы, копчености, консервы и соленья. В период ремиссии питание может быть более разнообразным и строгих ограничений не предусматривается. В рационе по прежнему важны витамины и микроэлементы, источниками которых являются зеленые овощи, фрукты, масло льняное и оливковое, рыбий жир, разнообразные орехи.
Профилактика
Методов профилактики не существует, поскольку не известны факторы, которые ведут к заболеванию. Больным рекомендуется постоянное наблюдение у гематолога. При лечении иммунохимическое исследование крови и мочи необходимо выполнять раз в 2−3 месяца.
Последствия и осложнения
Из последствий и осложнений данного заболевания можно выделить следующие:
- Анемия.
- Гиперкальциемия.
- Повышение уровня мочевой кислоты.
- Бактериальные или вирусные инфекции, которые из-за иммунодефицита протекают очень тяжело.
- Почечная недостаточность.
- Литические поражения костей и остеопороз. В большинстве случаев больным показано внутривенное введение бисфосфонатов (золедроновая кислота). Они уменьшают боль в костях и различные осложнения, связанные с остеопрозом. При реакциях на введение биофосфонатов может использоваться деносумаб (препарат Пролиа ежемесячно, подкожно).
- Спонтанные переломы костей.
- Компрессия спинного мозга. Является результатом прорастания опухоли из позвонков. У больных появляется боль как при радикулите, потеря чувствительности, парезы ног и даже нарушение функции тазовых органов. Вследствие компрессионных переломов отмечается риск легочных инфекций.
- Множественные тромбозы в связи с повышением вязкости крови.
- Распад крупной опухоли.
- В терминальной стадии — парапротеинемическая кома.
Прогноз при миеломе крови: можно ли вылечиться
Проблема «как вылечиться полностью» остается для больных нерешенной. Это потенциально смертельное заболевание, поскольку без лечения продолжительность жизни не более 6 месяцев. При стандартной химиотерапии выживаемость увеличилась до 3 лет, но полные и длительные ремиссии при множественной миеломе наблюдались редко. С появлением иммуномодуляторов (Ревмилид) и ингибиторов протеаз (Велкейд) увеличилась продолжительность жизни
Применение Велкейда изменило прогноз этого заболевания. В последнее десятилетие продолжительность жизни при миеломе увеличилась при I стадии до 6-7 лет (в отдельных случаях более 15 лет), а при при II стадии до 4 лет. Чего нельзя сказать о плазмацитоме 3 степени. Продолжительность жизни при множественной миеломе 3 степени самая низкая — не более 2 лет. Это связано с тем, что это стадия выраженных изменений в организме: низкий гемоглобин, высокий уровень кальция и парапротеина, выраженная деструкция костей, а сама опухолевая масса больших размеров.
Прогноз при миеломной болезни зависит от многих факторов. К неблагоприятным факторам, которые выявляются уже на момент диагностирования заболевания относятся низкий уровень альбумина, повышенный уровень лактатдегидрогеназы, повышенный бета-2-микроглобулин и цитогенетические аномалии. Прогноз у больных с почечной недостаточностью тоже неблагоприятный.
Список источников
- Менделеева Л. П., Вотякова О.М., Рехтина И.Г. Множественная миелома. Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний. Под ред. И.В. Поддубной, В. Г. Савченко. М., 2018. P.: 213–41.
- Бессмельцев С.С. Множественная миелома (патогенез, клиника, диагностика, дифференциальный диагноз) // Клиническая онкогематология. — 2013.— Т6, №3.— С. 237-257.
- Бессмельцев С.С., Абдукадыров К.М. Множественная миелома. Современный взгляд на проблему. Алматы, 2007.
- Моисеев С. И., Салогуб Г.Н., Степанова Н. В. Современные принципы диагностики и лечения множественной миеломы. – СПб.: Издательство СПбГМУ, 2006. – 39 с.
- Вотякова О.М. Множественная миелома: достижения лекарственного лечения XXXXI веков // Онкогематология. – 2004. – Т. 6, № 4 – С. 1925.





 Велкейд
Велкейд Циклофосфан
Циклофосфан Доксорубицин
Доксорубицин Алкеран
Алкеран













Последние комментарии
Людмила: Я пью квестран длительное время от хологенной диареи, скажите повышает ли препарат ...
Лилия: Где можно купить ма азь Проспидин
Гость: Напишите кто принимал инвермектин в уколах от паразитов, как рассчитывали дозу?
Мария: Посоветовала коллега, когда дочь болела, что ночью просыпалась и не могла спать из-за ...