Разработка вакцины от коронавируса
Общие сведения
Несмотря на определенное снижение темпов распространения коронавирусной инфекции COVID-19 в мире эпидемиологическая ситуация в целом остается угрожающей. Ситуация усложняется индивидуальными проблемами и трудностями, характерными для различных стран и континентов, в том числе и различиями показателей распространения инфекции, а также объективными возможностями систем здравоохранения.
Как показала практика введения карантина в различных странах мира, в том числе режима самоизоляции и жестких профилактических мероприятий, все это позволило снизить темпы распространения коронавируса SARS-CoV-2, уменьшить влияние на медицинскую инфраструктуру, однако полностью взять под контроль передачу вируса методами неспецифической профилактики в целом не удается.
Сложность определяется и такими факторами как нахождение различных стран на разных этапах борьбы с коронавирусной инфекцией и различиями в строгости ограничительных мероприятий: одни страны жесткие ограничительные мероприятия вообще не вводили (Швеция, Исландия, Финляндия, Дания, Норвегия, Беларусь), другие ввели строжайшие карантинные меры (Китай, Южная Корея, Япония, Гонконг), некоторые уже начали ограничительные меры ослаблять, а другие предпочитают продолжать сохранять режим строгой самоизоляции. А если к этому добавить колоссальный экономический ущерб от карантинных мероприятий, предусматривающих особый режим хозяйственно-экономической деятельности во время карантина, ограничение передвижения транспортных средств и населения, очевидно, что такой метод реагирования на пандемию COVID-19 может использоваться лишь как краткосрочная мера, а единственно перспективным методом борьбы с распространением заболевания является вакцинация от коронавирусной инфекции.
Массовая вакцинация – это единственный эффективный способ остановить пандемию и альтернативы ей не существует. Позволить человеческой популяции приобрести коллективный иммунитет естественным путем означает, что COVID-19 должны переболеть более 75-80 % всех людей, после чего коэффициент передачи инфекции снизится до уровней, при которых пандемия прекратится самостоятельно.
Несмотря на то, что у коллективного иммунитета существует серьезное преимущество в том, что носители высокого уровня антител к SARS-CoV-2 смогут жить и работать в обычном режиме даже в последующий период эпидемии коронавируса, человечество не может допустить естественного формирования коллективного иммунитета, поскольку тяжесть течения заболевания для определенных групп населения и отсутствие эффективного контроля за его распространением приведет к многочисленным жертвам среди населения и перегрузке систем здравоохранения даже в самых развитых странах, не говоря уже о странах со слабо развитой экономикой и низким уровнем доходов.
Но прежде всего рассмотрим понятие вакцина и вакцинация. Вакцинный препарат (вакцина) предназначен для создания специфической невосприимчивости против определенного заболевания путем стимулирования выработки в организме человека антител (т.е. путем активации антиген специфических Т-клеточных механизмов, которые используются иммунной системой человека для контроля за появлением инфекционного агента и его ликвидации). Соответственно вакцинация представляет собой введение в организм человека вакцинного препарата, содержащего антигены тех или иных возбудителей инфекционных болезней для создания иммунитета (невосприимчивости) к конкретному возбудителю. Стратегия вакцинации базируется на существовании феномена так называемой «иммунологической памяти» и иммунологической специфичности.
Высокая специфичность клеток иммунологической памяти к конкретному антигену обусловлена В- и Т-лимфоцитами и распространяется на клеточное и гуморальное звено иммунитета, что является основой для быстрого его распознавания и ускоренного реагирования на антигены чужеродных агентов. Важнейшими свойствами клеток памяти являются способность к рециркуляции, что обеспечивает их мобильность/широкое распространение в организме и большую продолжительность жизни, что обуславливает длительность иммунитета к инфекционным агентам. То есть, после вакцинации при повторной встрече с инфекционным агентом иммунная система организма начинает сразу вырабатывать антитела против антигена (инфекционного агента), что позволяет быстро его обезвредить и предотвратить повторное развитие болезни. Именно вакцина и обеспечивает непосредственно первое знакомство иммунной системы человека с антигеном. Иначе говоря, эффективные вакцины имитируют целевого инфекционного агента и подготавливают уже приобретенный иммунитет к последующей встрече с ним.
Глобальные события, к которым безусловно относится и пандемия коронавирусной инфекции COVID-19, всегда связаны с огромным количеством появления непроверенной, недостоверной (фейковой), а зачастую и просто спекулятивной информации, что не позволяет многим людям разобраться во многих вопросах, связанных с вирусом и в частности, нашли ли вакцину от коронавируса или нет, есть ли и создали ли вакцину? Противоречащая информация в интернете и сообщения, что вакцина уже создана многими научными институтами/фармкомпаниями в разных странах и проходит испытания на людях затрудняет ответ на вопросы о том, есть ли вакцина от коронавируса на сегодняшний день и вообще вакцина от коронавируса создана или нет.
Когда будет готова вакцина от коронавируса и на каком этапе находятся ее разработки?
Процесс разработки вакцин против SARS-CoV-2 был запущен сразу после того, как был полностью расшифрован геном вируса. В мире идет активная работа над множеством вакцин, перспективных против COVID-19. В настоящее время известно о 115 экспериментальных разработках вакцин, из которых 83 кандидатных вакцинных препарата по данным ВОЗ находятся в стадии активной разработки (77 разработанных прототипов вакцин на стадии доклинических испытаний, 6 прототипов на стадии клинических исследований на добровольцах). В тоже время, постоянно муссируемые в информационном пространстве вопросы о том, когда будет готова вакцина от коронавируса, когда появится, когда сделают или изобретут вакцину, почему нет вакцины от коронавируса и есть ли в России вакцина — остаются без ответа, что обусловлено целым рядом факторов.
Прежде всего, разработка вакцины от коронавируса и испытание вакцины является сложнейшим биотехнологическим процессом, включающим несколько различных этапов:
- доклиническая стадия (in vitro) — исследования на культурах клеток;
- стадия в системе (in vivo) — на чувствительных лабораторных животных;
- клиническое испытание вакцины от коронавируса, проводимое в 3 стадии (клинические исследования на нескольких десятках добровольцев, на нескольких сотнях людей и клинические испытания на нескольких тысячах человек).
Вакцина тестируется на безопасность для человека (наличие побочных эффектов), иммуногенность (способность индуцировать иммунный ответ), определяется оптимальная эффективная доза вакцины и кратность ее введения, способ и схема вакцинации. И только после этого можно четко определить помогает ли прививка от коронавируса (т.е. изучается клиническая и эпидемиологическая эффективность).
После завершения испытаний создается технология выпуска препарата и начинается промышленный выпуск вакцины, что также занимает определенное время. По сути, большую часть времени занимает не сам процесс разработки вакцинного препарата, а его испытание и подтверждение безопасности / достаточной эффективности вакцины. То есть, «создать вакцину» не означает, что ее можно сразу применять.
Многие компании, разрабатывающие вакцину, поспешили заявить, что ее создание можно ожидать уже в 2020 году. Некоторыми из них даже указывается дата выпуска вакцины. Одним из лидеров, объявившем о клинических испытаниях уже в мае своей рекомбинантной вакцины NVX-CoV2373, включающую вакцинные наночастицы и адъювант Matrix-M является биотехнологическая компания из США Новавакс Инк. (Novavax Inc.). О начале проведения испытаний экспериментальной вакцины против коронавируса SARS-CoV-2 заявили такие крупнейшие биотехнологические компании как Inovio Pharmaceuticals (США), фарм-компания Джонсон энд Джонсон (США) и ее подразделение в Бельгии (Janssen Pharmaceutica), Sanofi (Франция), Pfizer (США), CanSino Biologics (КНР) исследовательский центр канадского университета Саскачевана (VIDO-InterVac) и другие. Ниже приведена диаграмма распределения проектов ведущих компаний, разрабатывающих вакцину, по географическому принципу и отраслям.
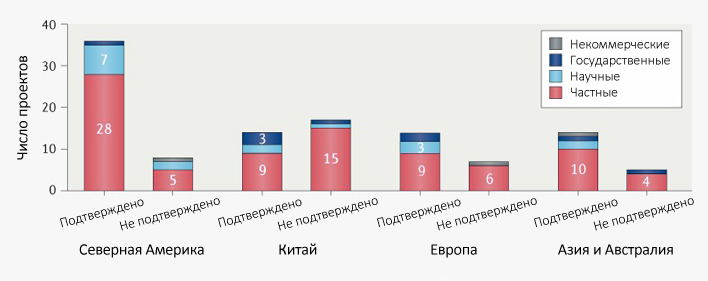
Географическое распределение разработок вакцин от COVID-19
Стремление создать вакцину в кратчайшие сроки породило и нездоровую конкуренцию. Многие политики, в частности Д. Трамп заявляют, что первая вакцина будет создана именно в США и даже анонсируется дата выхода. Более того Трамп пытался убедить ученых Германии в целесообразности переноса научно-исследовательской работы по созданию вакцины от коронавируса в США, обещая высокие гонорары. К сожалению, для стран — мировых лидеров создать вакцину первыми стало вопросом национального престижа и возможностью распространения своего влияния на различные менее развитые страны за счет оказания помощи пострадавшим от коронавирусной инфекции.
Вместе с тем растет понимание того, что любая готовая к использованию вакцина от COVID-19 должна рассматриваться не только с позиций коммерческой выгоды и оказания влияния на другие страны, а скорее, как мировое общественное благо, позволяющее цивилизации выжить и минимизировать потери, а это значит, что вакцинация от коронавируса должна быть доступной для всех. Очевидно, это и будет задачей наиболее развитых стран (G20). Э. Макрон уже инициировал сбор средств на борьбу против COVID-19 и заявил: «… Вакцина после ее изготовления должна стать всемирным общественным достоянием и будет принадлежать всем. Тактика каждый за себя в условиях пандемии станет большой ошибкой. Несмотря на стремление каждого государства защитить в первую очередь свое население мы сможем выйти из кризиса только совместными усилиями».
Несмотря на то, что вакцину необходимо создать в кратчайшие сроки, позиция ВОЗ относительно форсирования испытаний и особенно игнорирование некоторых его этапов негативна: «… Никто не должен пытаться вывести на рынок вакцину с недостаточной доказательной базой, ибо последствия действия некачественной вакцины, которая будет потенциально вводиться большей части человеческой популяции могут быть непредсказуемы». Эксперты считают, что ожидать появление вакцины с доказанной эффективностью и вакцинные программы массовой иммунизации стоит не раньше, чем через год, а купить вакцину каждый желающий сможет значительно позже. В принципе для человечества неважно, изобрели ли ее китайцы или американцы, где и кто придумают вакцину, важно, чтобы иммунизация населения достигла необходимого уровня в кратчайшие сроки.
Не менее важным сдерживающим фактором является высокая стоимость разработки вакцины. Так затраты для проведения вакцинного препарата-кандидата от стадии доклинических исследований до окончания клинических испытаний варьируют в пределах 31 — 70 млн долларов. В случаях неудачи на каком-либо этапе и необходимости в дополнительных исследованиях вакцинных препаратов-кандидатов, сумма с учетом расходов на лицензирование может увеличиться до 312–450 млн долларов. При этом, технологические различия вакцинной платформы существенного влияния на затратность разработок влияния не оказывает, то есть, материальные издержки как для традиционных, так и новаторских технологий практически одинаковы. Поэтому многие компании, например, Пфайзер Инк и БайоНТек (BioNTech) объединяют свои возможности для совместной разработки и распространения вакцины на платформе иРНК (вакцина BNT162) для профилактики инфекции COVID-19. И как сообщил генеральный директор BioNTech в комментарии CNN к концу 2020 года они могут выпустить миллионы доз вакцины BNT162 от коронавируса.
Появились и такие виды партнерского сотрудничества, как использование производственных мощностей других биотех-компаний. Так, компания Johnson & Johnson заключила соглашение с Emergent BioSolutions Inc об использовании ее предприятий для производства субстанций как минимум 1 млрд доз вакцины против COVID-19. О производственном партнерстве для разработки вакцины объявили также и Emergent BioSolutions с Vaxart.
Большой прорыв достигнут соглашением между CEPI (коалицией за инновации в сфере готовности к эпидемиям) и британской компанией GSK, благодаря которому биотех GSK с целью ускорения разработки вакцин-кандидатов предоставил доступ к своим разработкам по адъювантным системам, которые были разработаны для инновационных вакцин против пандемического гриппа. Включение в состав вакцины адъюванта проводится с целью стимуляции производства антител к вакцинному препарату (усиления иммунной реакции) и позволяет более эффективно решать задачи по формированию достаточного защитного ответа, что особенно актуально в ситуации пандемии. Кроме того, включение адъюванта в состав вакцины позволяет уменьшить дозы вакцинного антигена, требующегося для производства одной дозы вакцины. Соответственно такая «экономия антигена» позволит увеличить производство доз вакцины и сделать их более доступными для большего количества людей.
CEPI также финансирует чрезвычайно перспективный проект «РНК-принтер», который направлен на разработку автоматизированной легко транспортируемой установки для производства мРНК-вакцин. Такая установка способна «напечатать» в течение нескольких недель несколько грамм мРНК в составе липидных наночастиц, что достаточно для выпуска сотен тысяч доз вакцины. А его универсальность, экономичность и мобильность позволят использовать его для быстрого реагирования на эпидемические вспышки коронавируса в любой точке земли.
Вносят свой вклад в борьбу с коронавирусной инфекцией и компании немедицинского профиля, например, сеть распределенных вычислений Folding@home, производительность которых достигла рекордных скоростей и на платформе которой запущено сразу несколько проектов, направленных на разработку вакцины против коронавируса.
По мнению большинства ученых оснований думать, что вакцину от коронавируса разработать не удастся нет, поскольку вирус SARS-CoV-2 вызывает достаточный иммунный ответ, а достоверных данных, подтверждающих, что он каким-то образом подавляет или обманывает иммунную систему нет. Вопрос лишь в том, когда ее создадут, и какая вакцина будет наиболее эффективна и технологична. Также следует учитывать и необходимость финансировать не только процесс разработки и испытания вакцины, но и непосредственный процесс ее производства (создание принципиально новых производственных мощностей и расширение уже имеющейся производственной инфраструктуры) и затраты на логистику.
Разработка вакцины от коронавируса в России
Россия также активно разрабатывает вакцину от коронавируса. На сегодняшний день вакцина от коронавируса в России разрабатывается в нескольких специализированных научных центрах: Новосибирском ГНЦ «Вектор», Санкт-Петербургском НИИ вакцин и сывороток, ФМБА (Федеральным медико-биологическим агентством), биотехнологической компанией BIOCAD, филиалом «Медгамал» НИЦЭМ им. Н.Ф. Гамалеи и др. Эти компании имеют современные биотехнологии и технологические платформы, на основе которых и ведутся научные исследования. Как известно, Россия нашла одной из первых решение создания вакцины против вируса Эбола.
На сегодняшний день в перечень перспективных ВОЗ включила восемь российских разработок вакцин против коронавируса:
- векторная вакцина на основе живого вируса кори;
- векторная вакцина на базе вируса везикулярного стоматита;
- мРНК-вакцина;
- пептидная вакцина;
- субъединичная вакцина;
- интраназальная рекомбинантная вакцина на базе вируса гриппа А;
- вакцина инкапсулированная в липосомы мРНК;
- векторная живая вирусная вакцина на основе аттенуированного вируса гриппа.
То есть, по сути, вакцина от коронавируса создана в России практически одновременно с компаниями, являющимися мировыми лидерами в этой области и как свидетельствуют новости, сейчас все прототипы вакцин находятся на стадии их апробации.
Технологические особенности создания вакцины
Фармацевтические компании, занимающиеся разработкой лекарственных препаратов и вакцины от коронавируса SARS-CoV-2, используют как классические технологии, так и современные технологические платформы для создания синтетических вакцин (мРНК-вакцины, субъединичные и пептидные вакцины). Подбор технологической платформы (технологии создания вакцины) является чрезвычайно сложным процессом, во многом определяющим дальнейший процесс исследований. Рассмотрим некоторые из технологий.
Классическая технология разработки вакцины
Они могут создаваться как на основе живых ослабленных возбудителей болезни, так и инактивированных возбудителей, а также на основе более современных технологий, включающих в вакцину фрагменты вирусов/бактерий или анатоксины из обработанных специальным образом токсинов возбудителей. Иммунная система организма реагирует на них и при появлении такого же возбудителя она распознает его и нейтрализует.

Прототип вакцины ChAdOx1 nCoV-19
Вакцины такого рода — бактериальная и вирусная вакцина. Представлены препаратами, содержащими микроорганизмы аттенуированные разными типами воздействий на них. Они имеют существенные недостатки в виде: высокого риска реверсии вирулентности, высокой реактогенности, присутствия вирусов-контаминантов и химических инактиваторов, высокого содержания клеточного балласта, что затрудняет осуществление контроля качества при их производстве.
По сути, это технология создания вакцин первого поколения и тем не менее эта технология в рекомбинации с другими современными технологическими приемами продолжает использоваться. Примером такого подхода является прототип вакцины ChAdOx1 nCoV-19, которая создана на базе ослабленной версии аденовируса у шимпанзе, в которую добавлена часть генетического кода коронавируса или созданных на платформе других вакцин на основе вирусов гриппа А, кори, везикулярного стоматита, вируса Эбола.
Биосинтетические вакцины
Это вакцины второго поколения — белковая вакцина. В своем большинстве представлены рекомбинантными белками, аминокислотными последовательностями структур бактериального и вирусного белка, которые могут распознаваться иммунной системой человека и вызывать адекватный иммунный ответ. Такая рекомбинантная вакцина лишена недостатков вакцинных препаратов первого поколения и вызывают узко специфичный иммунный ответ.
Несмотря на относительно меньшую эффективность вакцин этого поколения в сравнении с исходным вирусом, что обусловлено меньшей иммуногенностью искусственно созданных участков, комбинированное использование нескольких различных иммуногенов позволяет обеспечить высокий/достаточный иммунный ответ при существенном снижении побочного действия вакцины и ее реактогенности, что является существенным конкурентным преимуществом. Примером может служить вакцина, созданная на базе субъединицы S-белка SARS-CoV-2 — S-Trimer с усилителем иммунной реакции (адъюванта). Поскольку такая вакцина вирусного материала не содержит, спектр ее побочных действий чрезвычайно низок
Еще одной технологической платформой является рекомбинантная экспрессия белков, отвечающих за сборку капсида в вирусных/дрожжевых системах. Установлено, что именно плотноупакованная белковая структура поверхности капсомера и опосредует его высокую иммуногенность. Эта технология позволяет получать вирусоподобные частицы (VLP), объединенные в структуру, близкую к оригинальному вириону. Функциональные физиологические характеристики VLP, сформированные капсидным белком, индуцируют выработку антител класса IgG, что и явилось базой для создания VLP-вакцин. Иммунизация животных вакциной VLP в эксперименте позволила защитить животных от последующего заражения вирусом. Канадская фарм-компания Medicago еще в марте 2020 года заявила о начале производства вирусоподобных частиц (VLP) коронавируса и ими же разрабатывается VLP-вакцина от коронавируса SARS-CoV-2.
Особого внимания заслуживают синтетические вакцины, создаваемые на различных технологических платформах. Одной из таких является транскрипционная технология с использованием синтетических матричных РНК (мРНК). Создаваемая на базе этой технологии мРНК-вакцина осуществляет кодирование белков-антигенов конкретного инфекционного агента, а иммунная система человека реагирует на них выработкой T-клеточного ответа.
Вакцинные препараты на базе мРНК обладают высоким потенциалом стимулирования T-клеточного ответа по сравнению с вирусными инактивированными и белковыми вакцинами. К преимуществам мРНК технологии можно отнести их способность имитировать естественные вирусные патогены, поскольку синтез мРНК-опосредованных антигенных белков вирусного патогена осуществляется непосредственно в клетках организма человека, где и осуществляются посттрансляционные модификации, аналогичные таковым, происходящим при натуральном жизненном цикле вируса, попадающем в организм. То есть, инъекция, содержащая РНК белка коронавируса, вызовет у человека иммунный ответ, при этом, фактически не заразив его полноценным вирусом.
Прототип вакцины mRNA-1273
Важнейшим преимуществом является и возможность мультиплексирования мРНК, то есть, одна вакцина может содержать несколько мРНК, которые кодируют несколько различных антигенов вирусных белков, что позволяет учитывать критические особенности вируса, в частности изменения в геноме вируса. Дополнительным преимуществом является возможность относительно быстрой разработки таких вакцин. Безусловным лидеров в создании мРНК-вакцин является компания США Модерна. Так, биотехнологическая компания Moderna совместно с NIAID (Национальный институт аллергии и инфекционных заболеваний) разработали вакцину mRNA-1273 (мРНК-1273), которая уже проходит тестирование на группе добровольцев. Вакцина мРНК-1273 кодирует специфический «белок-шип» — пепломеры (структуры в виде выраженных отростков на суперкапсидной липопротеиновой оболочке коронавируса SARS-CoV-2, являющегося своеобразным ключом вируса к клеткам человека). Также с этой технологией работают и такие крупнейшие биотехнологические компании, как CureVac AG (Германия), eTheRNA (Бельгия), Sanofi Paster (Франция), Translate Bio (США), Вектор (Россия) и другие.
Еще одной перспективной разработкой является вакцина Ad5-nCoV, разработанная компанией CanSino Biologics совместно с Пекинским институтом биотехнологий. В основе технологии — так называемый вирусный вектор, представляющий собой синтезированный вирус, который будет доставлять реципиенту генетический материал и при этом не будет обладать свойствами инфекционного агента.
Вакцины на основе генетического материала (РНК/ДНК-вакцина)
К относительно новым технологиям создания вакцин, имеющих высокий потенциал, относится и использование рекомбинантных ДНК и РНК. Такие вакцины представляют собой генно-инженерную конструкцию, которая начинает синтезировать белки вируса сразу после попадании в организм. Интерес к ним обусловлен универсальностью/простотой создания плазмид РНК, улучшением технологий доставки и созданием новых эффективных генетических конструкций, а также появлением новаторских перспективных технологий (PPLAV, iDNA, самоамплифицирующиеся РНК).
ДНК-вакцины в целом сходны с вакцинами на базе мРНК-технологий, однако ДНК-вакцины обладают большей устойчивостью и имеют несомненные преимущества перед традиционными. Примером ДНК-вакцин против SARS-CoV-2 является вакцинный препарат INO-4800, который разрабатывает компания Inovio Pharmaceuticals. Вакцинный препарат представляет собой плазмиды со встроенной готовой ДНК-последовательностью. Для проникновения плазмиды в клетки используется принцип электропорации устройства Cellectra, которое генерирует кратковременные электрические импульсы, вынуждающие клеточные мембраны открываться. Синтез антигена начинается через несколько дней.
Moderna и CureVac используют технологии на базе РНК. О совместной разработке ДНК-вакцины заявила фармацевтическая компания Энджес (AnGes), которая использует ДНК-плазмид HGF. По их мнению, они могут создать вакцину в более короткие сроки по сравнению с вакцинами, создающихся из белка вируса. К преимуществам вакцин на основе генетического материала относятся их способность индуцировать как гуморальный иммунитет (выработку антител), так и специфический клеточный иммунитет (активацию цитотоксических Т-лимфоцитов и макрофагов).
Пептидные вакцины
Вакцины на базе этой технологии включают набор аминокислот и фрагменты аминокислотной последовательности белка-антигена, организованные определенным образом в надмолекулярный комплекс или единую молекулу, которые могут распознаваться иммунной системой и вызывать достаточно выраженный специфичный Т и/или В-клеточный иммунный ответ.
Важнейшими компонентами пептидных вакцин, которые обеспечивают специфичность и направленность иммунного ответа, являются фрагменты молекул белков, обладающие В- и Т-эпитопной активностью. Также в состав вакцин могут включать надмолекулярные комплексы и индивидуальные соединения (частицы полимеров, мицеллы, липосомы), неспецифически/специфически активирующие некоторые стадии развития иммунного ответа на пептиды и усиливающие его. С целью улучшения химической стабильности пептиды могут присоединять к носителям, которые одновременно выступают в качестве активаторов иммунного ответа. Как свидетельствуют последние новости, пептидная вакцина на платформе, которая уже апробирована при разработке вакцины против вируса Эбола, создана в ГНЦ ВБ «Вектор» (Россия).
Нановакцины
Еще одной инновационной технологией являются нанотехнологии, на основе которых производятся нановакцины. Суть технологии состоит в ведении молекулы РНК в клетки, которая доставляются при помощи специально разработанных наночастиц, проникающих в клетку аналогично вирусам, где они распадаются и выбрасывают молекулы РНК. Клетка в свою очередь «считывает» молекулы РНК и начинает продуцировать белки, которые выявляются иммунной системой и в организме человека начинают вырабатываться антитела для борьбы с патогенами — обладателями таких пептидов. Одной их таких разработок является вакцинный препарат, созданный на основе рекомбинантного белка и наночастиц, созданный Петербургским НИИ вакцин и сывороток.
Молекулярный зажим
Также технологической новинкой, которую разрабатывает Квислендский университет является так называемый молекулярный зажим (molecular clamp). Она базируется на блокировании процесса слияния вирусной и мембраны клетки человека, то есть прерывания процесса инфицирования (блокирования процесса проникновения вируса в клетку). Технология молекулярных зажимов направлена на стабилизацию вирусных белков слияния фузогенов в их конформации «до слияния». Именно эта конформация содержит эпитопы, не присутствующие в конформации «после слияния», которые непосредственно индуцируют выработку высоко нейтрализующих и широко перекрестных антител в процессе сильного иммунного ответа.
Антителозависимое усиление инфекции (феномен ADE)
Одним из возможных негативных последствий с точки зрения безопасности создаваемых вакцин является риск усиления инфекции, известный как феномен ADE, определяемое как антитело-зависимое усиление инфекции, то есть, вакцина может усиливать действие коронавируса, а не защищать от него. Несмотря, что этот феномен относится к достаточно редким явлениям, исключить его появление пока невозможно. Аргументацию его возможного появления, усиливает тот факт, что похожим образом вели себя 2 близких родственника и предшественника SARS-CoV-2 — SARS (2003 г.) и MERS (2012 г.). И если выявится, что ADE характерно для нового коронавируса, разработка вакцины от COVID-19 будет чрезвычайно сложной или вообще безнадежной задачей.
Изменчивость коронавируса как фактор риска
Мутации SARS-CoV-2 (изменчивость вирусного генома) представляют собой процесс, естественный для любого вируса. Однако некоторые вирусы мутируют некритично и медленно, другие с высокой скоростью и множеством делеций (потерей участка генетического материала) в геноме вариона. Например, вирус кори относится к медленно мутирующим стабильным вирусам, вакцина от которого эффективна на протяжении уже многих десятков лет в отличии от вируса гриппа в геноме которого происходят частые мутации, что вызывает необходимость обновлять состав вакцин от гриппа ежегодно.
Поскольку SARS-CoV-2 относится к РНК-содержащим вирусам, для которых характерна относительно быстрая мутация вопрос скорости его мутации остается пока открытым и говорить в полной мере о его высокой изменчивости из-за недостатка данных о нем еще рано, хотя уже известно несколько штаммов/подтипов коронавируса. Это более агрессивный подтип L встречающийся в 70% случаев и менее агрессивный подтип S, встречающийся в 30% случаев.
В настоящее время у трех вариантов генома вируса SARS-CoV-2 выявлена лишь одна существенная мутация в виде полного/частичного удаления из генома вируса гена Orf8, который и отличается высокой изменчивостью. По мнению ряда авторов удаление гена Orf8 является первым существенным проявлением процесса адаптации коронавируса к организму человека, поскольку геномы вируса SARS содержали полный ген Orf8 на в ранних периодах вспышки атипичной пневмонии в 2003-2004 годах, и он также присутствует в геномах практически всех вирусов-предшественников. То есть, кодирующие генетические последовательности гена Orf8 вируса SARS постепенно претерпели его удаление в период вспышки атипичной пневмонии. Предполагается, что полная делеция гена Orf8 привела к уменьшению репликации (размножения) вируса и ослаблению его вирулентных качеств.
Выравнивание нуклеотидной последовательности по данным медицинского центра Университета Питтсбурга, позволило выявить 93 мутации по всему геному SARS-CoV-2:
- 42 миссенс-мутации обнаружены во всех основных структурных и неструктурных белках, за исключением белка оболочки;
- 29 миссенс-мутаций обнаружены в полипротеине ORF1ab;
- 8 — в гликопротеине шиповидных отростков;
- 4 — в нуклеокапсидном белке;
- 1 — в матриксном белке.
Однако, как известно к мутациям проявляют большую склонность поверхностные антигены, которые способствуют проникновению вируса в клетку, в частности гликопротеин шиповидный, который и определяет тропизм хозяина, а также играет основную роль в связывании с рецепторами клетки человека. Озабоченность ученых вызывают 3 мутации (D354, Y364 и F367), которые были выявлены в рецептор-связывающей части гликопротеина шиповидных отростков, которые теоретически могут вызвать конформационные изменения, способные привести к изменчивости антигенных свойств и антитела, нейтрализующие старый штамм, перестают распознавать «перевоплотившийся» вирус.
Однако, по мнению большинства исследователей нуклеотидные последовательности в геномах SARS-CoV-2 на сегодняшний день чрезвычайно сходны (99.8%). А те мутации вариона, которые происходят «быстро», в своем большинстве не затрагивают белок оболочки (S-белок) и поскольку разрабатываемые вакцины способствуют выработке иммунитета именно против белков оболочки, то вирус, с точки зрения иммунизации достаточно стабилен и это хороший признак. Также пока отсутствуют достоверные данные о том, что эти генетические отличия SARS-CoV-2 транслируются в биологические – степень вирулентности/контагиозности и другие.
Но что будет дальше остается под большим вопросом, поскольку SARS-CoV-2 циркулирует в человеческой популяции совсем не долго (предположительно с октября-ноября 2019 года). Приведет ли эволюция коронавируса к появлению биологически различимых подтипов остается пока риторическим вопросом. Если да, то вакцина против коронавирусной инфекции должна будет ежегодно «коррелироваться» с конкретным штаммом вируса, т.е. в вакцину необходимо будет вводить различные антигенные варианты коронавируса. И если в кратко-среднесрочном периоде это с большой долей вероятности не произойдет, то в отдаленной перспективе к этому необходимо быть готовыми.
Связь с прививками от других вирусов
Периодически в информационном поле появляются сообщения, что вакцина от других вирусов может помочь и от нового коронавируса SARS-CoV-2. Многие спрашивают помогает ли прививка от гриппа при коронавирусе, защитит или спасет прививка от пневмококка при коронавирусе, поможет от коронавируса прививка от пневмонии?
К сожалению, что касается так называемого перекрестного иммунитета — это фейковая информация, не соответствующая действительности. Ни прививка от гриппа, ни от пневмококка, ни от какого-либо другого этиологического агента не защищает от коронавируса, поскольку каждая из этих прививок формирует типоспецифический иммунитет. Тем более не может быть какой-либо прививки от пневмонии, поскольку это полиэтиологическое заболевание, которое может вызывать самые различные инфекционные агенты (бактерии, вирусы, грибы). То есть, например, пневмококковая прививка может защитить лишь от заболеваний, вызываемых непосредственно пневмококком. Однако, по данным профессора Кауфмана прививка от пневмококка, хотя и не дает общей защиты от коронавирусов, но может использоваться в качестве дополнительной защиты от SARS-CoV-2. То есть, если пациент получил прививку от пневмококка, являющегося возбудителем ряда типичных заболеваний дыхательных путей, то риск развития коинфекции (одновременного заражения одной клетки разными видами вирусов) существенно снижается, что особенно важно для людей пожилого возраста. Также дискутируется вопрос о наличии перекрестного иммунитета у двух циркулирующих вариантов коронавируса (S и L варианты).
 В научных кругах активно обсуждается возможность использования прививки от туберкулеза (БЦЖ) для профилактики от COVID-19. Эпидемиологи Техасского университета и ряда других научно-исследовательских лабораторий выяснили, что у стран с активными программами вакцинации от туберкулеза случаев заражения COVID-19 в 10/12 раз меньше по сравнению со странами, где антитуберкулезная программа не проводится.
В научных кругах активно обсуждается возможность использования прививки от туберкулеза (БЦЖ) для профилактики от COVID-19. Эпидемиологи Техасского университета и ряда других научно-исследовательских лабораторий выяснили, что у стран с активными программами вакцинации от туберкулеза случаев заражения COVID-19 в 10/12 раз меньше по сравнению со странами, где антитуберкулезная программа не проводится.
Некоторые эксперты высказали предположение, что БЦЖ стимулирует общий естественный иммунный фон в организме человека к вирусным заболеваниям дыхательных путей, что в определенной степени сможет защитить и от коронавируса и не исключено, что прививку БЦЖ можно будет использовать с этой целью до тех пор, пока на рынке не появится вакцина от коронавируса. Но большинство ученых считают, что это эффект еще не изучен и его клиническая значимость неизвестна. Позиция ВОЗ по использовании вакцины БЦЖ негативна, поскольку достоверных доказательств ее эффективности нет и использовать БЦЖ для профилактики инфекции COVID-19 не рекомендует. Также в ВОЗ подвергли критике публикации о влиянии БЦЖ на заболеваемость COVID-19 в зависимости от интенсивности противотуберкулезной вакцинации, считая эти исследования предвзятыми и некорректными с позиции статистики и демографии.
Стратегия вакцинации населения от COVID-19
Несмотря на то, что вакцина против коронавирусной инфекции еще находятся в стадии разработки и испытания, в прессе широко дискутируется вопрос о стратегии вакцинации населения. Очевидно, что стратегия вакцинации будет разработана ВОЗ и каждая страна может ее имплементировать у себя. Однако уже сейчас в ряде стран считают, что это должна быть обязательная вакцинация для всего населения. Более того, принудительная вакцинация от коронавируса в некоторых странах прописывается в законодательстве.
Так, Дания приняла закон, согласно которому правительство во время эпидемии коронавируса может заставлять граждан проходить тестирование и вакцинацию от коронавируса в принудительном порядке в период до марта 2021 года. Закон дает властям широкие полномочия и предусматривает ограничения посещения общественных мест, штрафы и тюремный срок гражданам, отказывающимся от тестирования или вакцинации. Жесткие меры в отношении обязательности прививок от тех или иных заболеваний существуют и в других странах Европы (Франции, Германии, Чехии, Польше, Сербии, Болгарии, Италии, Венгрии и др.) и нарушения в этой сфере жестко наказываются.
Однако существует и большая группа стран, в которых вакцинация является добровольной и по мнению органов здравоохранения вакцинация должна быть осознанной, то есть, делать ли ребенку прививку решают родители. ВОЗ включила отказ от прививок в 2019 году в десятку основных угроз для здоровья. Прививки являются наиболее эффективным социальным и эпидемиологическим средством борьбы с инфекционными заболеваниями, которые существуют в арсенале человечества, являющееся к тому же и самым рентабельным экономически.
Вакцинация в России не относится к обязательным процедурам за исключением отдельных категорий лиц и вакцинации по эпидемическим показаниям. Вакцинация, как и все медицинские манипуляции в России может проводится лишь после получения добровольного информированного согласия со стороны пациента или законного представителя для детей до 15 лет, согласно закона «Об основах охраны здоровья граждан в РФ» N 323-ФЗ от 21.11 2011 года.
Делать ли или не делать прививки детям, несмотря на убедительные статистические и научные доказательства эффективности и безопасности вакцин широко дискутируется в средствах массовой информации. И во многих странах пропаганда отказа от прививок становится настоящим вызовом, противоречащим здравому смыслу. Чего стоит только растущее общественно-политическое антипрививочное движение, адепты которого широко распространяют через социальные сети настороженность в отношении вакцин и призывы отказа от них, призывая своих сторонников изменить закон об обязательной вакцинации. Сторонники этого движения утверждают, что, что медицинская общественность, продвигая вакцинацию как социальную норму, скрывает неблагоприятные последствия прививок для детей, а необходимость прививок объясняют финансовыми интересами фармакологических компаний, производящих вакцины. Уже с середины марта звучат призывы отказаться и от вакцинации против коронавирусной инфекции COVID-19, поскольку она является предлогом для введения принудительной вакцинации с целью внедрения в тела вакцинируемых лиц «наночипов» для установления на планете тотального контроля за населением.
Безусловно, с эпидемиологических позиций вакцинацией необходимо охватить максимум населения, то есть, прививку должны сделать подавляющее большинство населения в мире, чтобы иммунизация населения достигла необходимого уровня в кратчайшие сроки. Однако этот очевидный факт может не совпадать с реальными возможностями. Например, нет никаких гарантий, что вакцина появится сразу в необходимых объемах даже если одновременно будут разработаны 2-3 вакцины и что удастся охватить прививками в глобальном масштабе значительную часть населения. Так население планеты составляет около 7,8 млрд, а производство всех вместе взятых вакцин в мире находится на уровне около 5 млрд доз и из них около 1,5 млрд приходится на сезонный грипп. И даже если все производственные мощности перевести исключительно на прививки от COVID-19, что практически невозможно, то для полной вакцинации населения потребуется как минимум 2-3 года. Очевидно, при такой ситуации стратегия вакцинации может быть изменена с учетом основных групп риска, территорий с высоким темпом заражения, наличия предпосылок для эпидемической заболеваемости.
Некоторые авторы считают, что во время эпидемии в условиях дефицита вакцин, основной группой для прививок должны стать лица повышенного риска (по возрасту, наличию хронических заболеваний), а прививка против коронавируса детям и лицам до 30 лет могут проводится лишь по возможности. Такой подход имеет смысл с точки зрения снижения числа тяжелых осложнений и летальных случаев, однако с позиций эпидемиологии именно дети и молодые люди, переносящие коронавирус без симптомов или с легкими проявлениями являются основным источником ее распространения.
Некоторые ученые считают, что полная поголовная вакцинация труднодостижима, да и она и не потребуется, поскольку у определенной населения вырабатывается естественный иммунитет при бессимптомных и манифестных случаях заболевания. Но, по их мнению, он будет недостаточным, так как антитела вырабатывается в организме в количестве достаточном лишь для нейтрализации коронавируса. Оптимальным вариантом была бы возможность для каждого человека сдать тест на антитела, то есть, понять, переболел он уже или нет и принимать решение о вакцинации исходя из результата теста. Однако, по мнению большинства вирусологов и эпидемиологов ВОЗ должна сделать вакцинацию от COVID-19 обязательной для всего населения и по мнению ряда ученых после разработки вакцины прививку от коронавируса в дальнейшем необходимо будет делать всем в детстве.
Плановая вакцинация в период пандемии коронавирусной инфекции
Можно ли делать прививки во время коронавируса детям и взрослым? Вопрос о том, делать ли прививку ребенку во время коронавируса, несколько раз дискутировался и 5 марта 2020 года Роспотребнадзор рекомендовал приостановить плановую иммунизацию населения во всех субъектах РФ до стабилизации эпидемиологической ситуации, за исключением детей в роддоме. Однако согласно методическим указаниям МЗ РФ от 24.04.2020 плановые прививки здоровым неконтактным детям не останавливаются и проводятся в соответствии с национальным календарем прививок. Особо подчеркнута необходимость вакцинации восприимчивых пациентов и лиц из групп риска против кори, полиомиелита, пневмококковой инфекции, сезонного гриппа и гемофильной инфекции типа b. При этом подчеркнуто, что иммунизацию необходимо проводить в условиях строгого соблюдения профилактических мер по предупреждению распространения коронавирусной инфекции COVID-19.
Позиция ВОЗ по поводу вакцинации во время пандемии однозначна и сводится к важности и необходимости проведения плановой иммунизации в период пандемии. В противном случае контролируемые сейчас инфекции могут вызвать вспышечную заболеваемость, привести к повышению смертности, особенно среди групп риска, что будет являться дополнительной нагрузкой на систему здравоохранения.
Тестирование на стойкий иммунитет
Существенной помощью в изучении состояния и формирования стойкого долговременного иммунитета у населения к коронавирусной инфекции COVID-19 и его дрейфа, а также для коррекции стратегии вакцинации может стать широко проводимый лабораторный анализ (скрининг) на определение наличия в плазме крови человека специфических иммуноглобулинов класса G, высокий титр которых в крови свидетельствует о наличии у обследованных лиц долговременного стойкого иммунитета. Такие данные чрезвычайно полезны для контроля создаваемой вакцины на всех этапах (как во время ее испытаний, так и для оценки эффективности ее использования), а также при проведении научных эпидемиологических исследований. С этой целью для первичного скрининга могут использоваться наборы на основе ПЦР, в качестве дополнения к скрининговым ПЦР-тестам могут использоваться серологические методы диагностики — диагностикумы (наборы) для определения специфических анти-SARS-CoV-2 антител классов IgG и IgA методом иммуноферментного анализа (ИФА), в которых, благодаря использованию рекомбинантного антигена S1, перекрестная реакция с другими видами коронавируса практически отсутствует, что обеспечивает чрезвычайно высокую специфичность анализа. По сообщениям ряда научных организаций запуск таких тестов для широкого применения начнется в ближайшее время.
По мнению многих исследователей широкие лабораторные анализы, позволяющие определить состояния иммунитета к коронавирусной инфекции, будут началом индивидуального подхода к вакцинированию, а разработка вакцины и методики вакцинирования должна проводится с учетом особенностей различных возрастных групп.
Профилактиктические мероприятия
В период отсутствия вакцины неспецифические профилактические мероприятия являются единственно действенным способом борьбы с пандемией коронавируса, позволяющими разорвать пути распространения вируса, своевременно выявить и изолировать зараженных лиц, особенно с тяжелой симптоматикой. Эти мероприятия всем известны, однако существует большой разброс мнений о «жесткости» карантинных мероприятий. С одной стороны китайский вариант жесткого карантина, с другой стороны — страны скандинавского полуострова, реализующих вариант мягкого карантина. Очевидно, что Китай, Южная Корея, Тайвань, Гонконг быстро среагировали жесткими карантинными мерами, которые принесли успех и позволили добиться впечатляющих результатов, в то время, как другие экономические развитые страны Европы (Италия, Испания, Франция, Германия) и США, опоздавшие с введением жестких мер проходят тернистый путь борьбы с быстрым распространением коронавируса, высокой смертностью и чрезвычайно высокой нагрузкой на системы здравоохранения этих стран.
Среди экспертов существуют два полюса в подходе к мерам неспецифической профилактики, обозначающиеся терминами сдерживание (containment) и смягчение (mitigation). Особо принципиальных различий между ними нет, поскольку каждая из них предусматривает введение ограничительных мер, весь вопрос в их объеме, длительности и строгости контроля за их соблюдением. И конечно оба варианта не являются идеальными.
Стратегия сдерживания делает упор на жесткое и быстрое подавление распространения инфекции до стадии, когда скорость распространения инфекции становится крайне низкой и отдельные ее случаи можно уже контролировать вручную, что позволяет эффективно подавлять экспоненциальный рост инфекционной заболеваемости на первом этапе и снизить нагрузку на систему здравоохранения. Однако жесткие меры удерживать долго невозможно, а при низкой заболеваемости и смертности такая стратегия может сдвинуть появление новой вспышки в будущее и при этом, лишь незначительно уменьшить ее абсолютный масштаб. Кроме того, такая стратегия сопряжена с максимальным экономическим ущербом, что является не менее опасным для стран со слабой экономикой.
Стратегия смягчения фокусируется на контроле за скоростью роста эпидемии с одновременной минимизацией экономического ущерба. Карантинные мероприятия позволяют появляться новым заболевшим, но при этом, рост их численности не должен быть слишком резким, чтобы не вызвать коллапса медицинской инфраструктуры. То есть, довольно быстро увеличивается одновременное число переболевших, что снижает потенциал вспышки, но при этом, неизбежно растет число смертельных случаев.
Обе стратегии имеют аргументацию за и против, сторонников в сообществе экспертов. Но однозначно ответить, какая из них в краткосрочной/долгосрочной перспективе будет наиболее эффективной невозможно. В настоящий момент большинство экспертов склоняется к мнению, что «жесткость» карантинных мероприятий должна соответствовать специфике страны и ее национальным особенностям — экономическому развитию страны, демографическим показателями, менталитету национального большинства граждан страны, отношениям между гражданами и государством, законодательству, плотности населения и застройки населенных пунктов, промышленной структуре, транспортной системе и другим факторам, во многом определяющих число контактов. В соответствии с этими показателями и должны строиться модели ограничительных мероприятий и рассчитываться их влияние на эпидемию.
Прогноз на будущее
Прогнозировать как будет развиваться ситуация с коронавирусной инфекцией COVID-19 в мире чрезвычайно трудно, что определяется множеством факторов, которые пока остаются не предсказуемыми, например, появится ли вакцина до окончания пандемии и какова будет ее эффективность, насколько быстро будет мутировать вирус, снизится ли скорость распространения и заболеваемость коронавирусной инфекцией с наступлением теплой солнечной погоды, как быстро сформируется коллективный иммунитет и т.д. Принципиально существует целая группа сценариев оптимистического и пессимистического развития ситуации.
Несмотря на оптимистические последние новости о вакцине от коронавируса, исключить ее появление после того, как пандемия сойдет на нет нельзя. Последующие же волны пандемии, которые могут протекать тяжелее либо легче будут вызываться мутировавшими видами коронавируса, что потребует разработки «вакцинного коктейля» из 2-3 антител или, как вариант, создание «биоспецифических» антител, одновременно взаимодействующих с несколькими молекулярными мишенями, что потребует дополнительного времени и финансирования.
Также нет доказательств о том, что для SARS-CoV-2 характерна сезонность, что уже подтверждается отсутствием различий в распространении коронавируса как в зимний период, так и в странах, где сейчас лето (в Бразилии, Мексике, Индии и Пакистане), то есть, где жарко и присутствует жесткое ультрафиолетовое облучение.
Существует предположение и о том, что генетический материал коронавируса пройдя множество пассажей изменится, а его патогенность снизится, что позволит ему закрепится в человеческой популяции и он будет возвращаться каждый осенне-зимний-весенний сезон, выступая в качестве одного из этиологических агентов ОРВИ по аналогии с ОРВЗ или гриппом, но в масштабах значительно меньших, чем сейчас. Или как вариант в виде вспышечной заболеваемости в той или другой стране. По мнению многих эпидемиологов, коронавирус останется в популяции людей навсегда и даже после разработки вакцины по своей опасности он будет находиться на уровне гриппа.
Открытым остается и вопрос о длительности иммунитета против коронавируса SARS-CoV-2. В основе предположения о наличии достаточно длительного иммунитета — исследования последствий эпидемий вирусов (SARS-CoV и MERS), имеющих около 80% геномной идентичности с SARS-CoV-2. При заболеваниях, вызываемыми этими вирусами у переболевших вырабатывался стойкий иммунитет, сохраняющийся на протяжении нескольких лет. Однако, эти данные недостаточны для уверенного утверждения, что инфекция SARS-Cov-2 даст переболевшим людям стойкий иммунитет.
Таким образом, человечество пока еще слишком мало знает об SARS-CoV-2 и поэтому необходимо быть готовыми к любому развитию ситуации. Фиксация на каком-либо одном прогнозе без акцента на его неопределенность является чрезвычайно опасной и может очень дорого обойтись обществу.

















Доказательства что я переболел именно коронавирусом.На второй день после заражения прошёл ПЦР тест результат толи болен толи нет Когда заболел и когда выздоровел 33 поликлиника г.Альметьевска в курсе. Неопровержимые доказательства моего иммунитета. Через 4 месяца после перевакцинации спутником лайт сделал анализ антитела к коронавирусу 201 врачи утверждают что переболел, а через месяц этот же самый анализ показал 316 врачи утверждают что обратно переболел. Оба раза переболел бессимптомно.